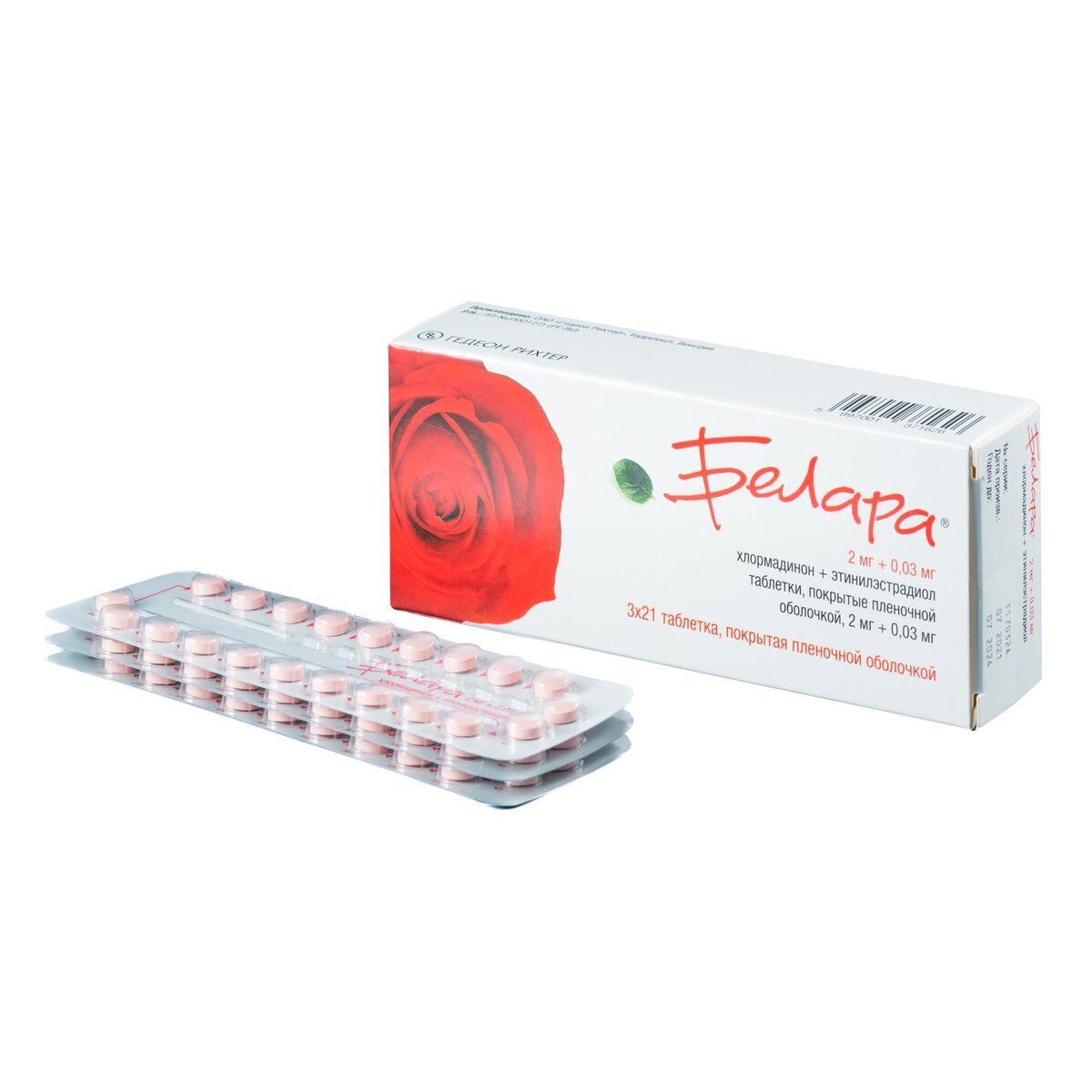
Белара таблетки 63 шт. в Клинцах




Самовывоз в Клинцах бесплатно
Оплата при получении в аптеке
Форма выпуска:
Фасовка:
Действующее вещество Белара:
Производитель:
Условия отпуска Белара:
Страна:
Как сделать заказ?
Информация производителя
Способ применения и дозировка
Препарат следует принимать внутрь. Таблетку, обозначенную соответствующим днем недели, следует извлечь из блистерной упаковки и проглотить целиком, не разжевывая и запивая небольшим количеством воды. Следует принимать по 1 таблетке ежедневно, в одно и то же время (предпочтительно вечером) в течение 21 дня подряд, затем следует сделать 7‑дневный перерыв в приеме таблеток. Через 2–4 дня после приема последней таблетки должно начаться менструальноподобное кровотечение. После окончания 7‑дневного перерыва следует приступить к приему препарата из следующей упаковки, независимо от того, прекратилось кровотечение или нет.
Начало приема препарата (если никакое гормональное контрацептивное средство не применялось в течение последнего менструального цикла)
Прием препарата следует начинать в первый день менструального цикла (т.е. в первый день менструального кровотечения), согласно дню недели, указанному на упаковке препарата. Далее следует принимать таблетки по порядку. Допускается начало приема препарата на 2–5 день менструального цикла, но в этом случае в течение первых 7 дней приема таблеток препарата Белара® рекомендуется дополнительно использовать барьерный метод контрацепции (например, презерватив).
Если менструальное кровотечение началось более 5 дней назад, женщине следует рекомендовать дождаться начала следующего менструального кровотечения, чтобы приступить к приему препарата.
При переходе с других комбинированных контрацептивных препаратов (КОК, вагинального кольца или трансдермального пластыря)
Начинать прием препарата рекомендуется на следующий день после приема последней таблетки из предыдущей упаковки (для препаратов, содержащих 21 таблетку) или на следующий день после приема последней таблетки с гормонами из предыдущей упаковки (для препаратов, содержащих 28 таблеток в упаковке). Дополнительные контрацептивные меры при этом не требуются.
Прием препарата Белара® следует начинать в день удаления вагинального кольца или пластыря, но не позднее дня, когда должно быть введено новое кольцо или наклеен новый пластырь.
Переход от препаратов, содержащих только гестаген («мини-пили», инъекционные формы, имплантат), или с внутриматочной терапевтической системы с высвобождением гестагена
Перейти с «мини-пили» на препарат Белара® можно в любой день (без перерыва), с имплантата или внутриматочного контрацептива с гестагеном — в день его удаления, с инъекционной формы — со дня, когда должна быть сделана следующая инъекция. Во всех случаях — в течение первых 7 дней приема таблеток препарата Белара® необходимо дополнительно использовать барьерный метод контрацепции (например, презерватив).
После самопроизвольного или медицинского аборта в первом триместре беременности
Начинать прием препарата Белара® можно сразу же. В этом случае применения дополнительных мер контрацепции не требуется.
После родов (при отсутствии грудного вскармливания) или прерывания беременности (в том числе самопроизвольного) во втором триместре
Начинать прием препарата рекомендуется на 21–28 день после родов (при отсутствии грудного вскармливания), или сразу после прерывания беременности (в том числе самопроизвольного) во втором триместре. Если прием препарата начат позднее, необходимо использовать дополнительно барьерный метод контрацепции в течение первых 7 дней приема таблеток. Если половой контакт имел место до начала приема контрацептива, необходимо исключить беременность.
После прекращения приема препарата Белара® текущий цикл может удлиниться примерно на одну неделю.
Рекомендации в случае пропуска приема препарата
Если опоздание в приеме препарата составило менее 12 часов, контрацептивная защита не снижается. Нужно принять пропущенною таблетку как можно скорее, следующая таблетка принимается в обычное время.
Если опоздание в приеме препарата составило более 12 часов, контрацептивная защита может быть снижена.
В случае пропуска таблетки необходимо помнить:
1) прием препарата Белара® никогда не должен быть прерван более чем на 7 дней;
2) 7 дней непрерывного приема препарата требуются для достижения адекватного подавления гипоталамо-гипофизарно-яичниковой системы.
Соответственно, если опоздание в приеме таблеток составило более 12 часов и интервал с момента приема последней таблетки больше 36 часов, женщине необходимо соблюдать следующие рекомендации: необходимо принять последнюю пропущенную таблетку незамедлительно, даже если это означает прием двух таблеток одновременно. Следующая таблетка принимается по обычной схеме. В течение последующих 7 дней необходимо дополнительно использовать барьерный метод контрацепции (например, презерватив). Если половой контакт имел место в течение недели перед пропуском таблетки, необходимо учитывать возможность наступления беременности.
Если в текущей упаковке осталось менее 7 таблеток, сразу же после окончания приема таблеток препарата Белара® следует начинать принимать таблетки из новой упаковки — т.е. без обычного 7‑дневного перерыва. Вероятно, обычное кровотечение «отмены» не возникнет, пока не закончатся таблетки из второй упаковки. Однако, во время приема таблеток из новой упаковки возможно появление «прорывного» кровотечения или «мажущих» кровянистых выделений из влагалища. Если кровотечение «отмены» не возникнет после окончания приема таблеток из второй упаковки, то следует сделать тест на беременность.
Рекомендации в случае желудочно-кишечных расстройств
При тяжелых желудочно-кишечных расстройствах всасывание препарата может быть неполным, поэтому следует использовать дополнительные методы контрацепции. Если в течение 3–4 часов после приема таблетки произошла рвота или была диарея, в зависимости от недели приема препарата следует ориентироваться на рекомендации при пропуске таблеток, указанные выше.
Отсрочка начала менструальноподобного кровотечения
Для того, чтобы отсрочить начало менструальноподобного кровотечения, необходимо продолжить дальнейший прием таблеток из новой упаковки препарата без обычного 7‑дневного перерыва. Таблетки из новой упаковки могут приниматься так долго, как это необходимо, в том числе до окончания упаковки. На фоне приема препарата из второй упаковки могут отмечаться «мажущие» кровянистые выделения из влагалища и/или «прорывные» кровотечения. Возобновить прием препарата из очередной упаковки следует после обычного 7‑дневного перерыва.
Изменение дня начала менструальноподобного кровотечения
Для того, чтобы перенести день начала менструальноподобного кровотечения на другой день недели, женщине следует сократить ближайший 7‑дневный перерыв в приеме таблеток на столько дней, на сколько она хочет. Чем короче перерыв в приеме таблеток, тем выше вероятность, что менструальноподобное кровотечение не наступит, и во время приема таблеток из второй упаковки будут наблюдаться «мажущие» кровянистые выделения и/или «прорывные» кровотечения.
Описание
Состав
1 таблетка, покрытая пленочной оболочкой, содержит:
Действующие вещества:
Хлормадинона ацетат — 2 мг,
Этинилэстрадиол — 0,03 мг;
Вспомогательные вещества:
Повидон‑K30, крахмал кукурузный, лактозы моногидрат, магния стеарат;
Пленочная оболочка:
Гипромеллоза 6 мПа × с, лактозы моногидрат, макрогол‑6000, пропиленгликоль, тальк, титана диоксид, краситель железа оксид красный.
Фармакотерапевтическая группа
Показания
Пероральная контрацепция.
Перед назначением препарата Белара® следует оценить наличие у женщины индивидуальных факторов риска развития тромбозов и тромбоэмболий, особенно венозной тромбоэмболии (ВТЭ), а также сравнить риск ВТЭ при приеме препарата Белара® с другими комбинированными гормональными контрацептивами (КОК) (см. разделы «Противопоказания» и «Особые указания»).
Противопоказания
Применение комбинации хлормадинон + этинилэстрадиол противопоказано при наличии любого из нижеперечисленных заболеваний/состояний или факторов риска:
- венозный тромбоз или ВТЭ, в том числе, тромбоз глубоких вен (ТГВ), тромбоэмболия легочной артерии (ТЭЛА), в настоящее время или в анамнезе;
- артериальный тромбоз или тромбоэмболия (АТЭ), в том числе инфаркт миокарда, инсульт или продромальные состояния (в том числе, транзиторная ишемическая атака (ТИА), стенокардия) в настоящее время или в анамнезе;
- выявленная наследственная или приобретенная предрасположенность к ВТЭ или АТЭ, включая резистентность к активированному протеину C, гипергомоцистеинемию, дефицит антитромбина III, дефицит протеина C, дефицит протеина S, антифосфолипидные антитела (антитела к кардиолипину, волчаночный антикоагулянт);
- наличие множественных факторов высокого риска развития ВТЭ или АТЭ (см. раздел «Особые указания») или одного серьезного фактора риска, такого как:
· сахарный диабет с диабетической ангиопатией;
· тяжелая дислипопротеинемия;
· неконтролируемая артериальная гипертензия (артериальное давление 160/100 мм рт. ст. и выше);
- мигрень с очаговой неврологической симптоматикой в анамнезе; впервые появившиеся приступы мигренозной боли или появление необычно сильной головной боли;
- обширное оперативное вмешательство с длительной иммобилизацией;
- панкреатит в настоящее время или в анамнезе, сопровождающийся выраженной гипертриглицеридемией;
- неконтролируемый сахарный диабет;
- тяжелые нарушения липидного обмена;
- острые или хронические заболевания печени тяжелой степени (до нормализации показателей функции печени), в т.ч. в анамнезе;
- генерализованный зуд, холестаз, особенно во время предшествующей беременности или приема половых гормонов в анамнезе;
- нарушение экскреторной функции печени, в том числе, синдром Дубина‑Джонсона, синдром Ротора;
- опухоли печени (доброкачественные и злокачественные), в т.ч. в анамнезе;
- сильная боль в эпигастрии, увеличение печени или симптомы внутрибрюшного кровотечения;
- гормонозависимые злокачественные новообразования половых органов или молочной железы (в т.ч. подозрение на них);
- острые сенсорные нарушения, например, нарушения зрения или слуха;
- двигательные нарушения (в частности, парезы);
- порфирия, возникшая впервые или рецидивирующая (все 3 формы, особенно — приобретенная);
- отосклероз, прогрессировавший во время предыдущих беременностей;
- тяжелая депрессия;
- увеличение частоты судорожных приступов при эпилепсии;
- гиперплазия эндометрия;
- аменорея неясной этиологии;
- кровотечение из половых путей неясной этиологии;
- беременность (в т.ч. предполагаемая);
- период грудного вскармливания;
- гиперчувствительность к хлормадинону и/или этинилэстрадиолу, или к любому из вспомогательных веществ в составе препарата;
- возраст до 18 лет (в связи с отсутствием данных по эффективности и безопасности применения комбинации хлормадинон + этинилэстрадиол у девочек‑подростков в возрасте до 18 лет);
- совместное применение с противовирусными препаратами прямого действия, содержащими омбитасвир/паритапревир/ритонавир и дасабувир (см. разделы «Взаимодействие с другими лекарственными средствами» и «Особые указания»);
- непереносимость лактозы, дефицит лактазы, синдром глюкозо-галактозной мальабсорбции.
При возникновении любого из данных заболеваний/состояний или факторов риска на фоне применения контрацептива, прием препарата следует немедленно прекратить.
С осторожностью
При наличии следующих состояний/заболеваний/факторов риска, в настоящее время или в анамнезе, применение комбинации хлормадинон + этинилэстрадиол требует тщательного медицинского наблюдения и оценки потенциального риска и ожидаемой пользы:
- эпилепсия, рассеянный склероз;
- судорожный синдром (тетания);
- мигрень без очаговой неврологической симптоматики;
- бронхиальная астма;
- хроническая сердечная или почечная недостаточность;
- малая хорея;
- сахарный диабет c неосложненным течением;
- хронические заболевания печени при нормальных показателях функциональных проб печени;
- аутоиммунные заболевания (включая системную красную волчанку);
- ожирение;
- дислипопротеинемия, контролируемая артериальная гипертензия;
- эндометриоз;
- варикозная болезнь, флебит поверхностных вен нижних конечностей;
- нарушение свертывающей системы крови;
- мастопатия;
- миома матки;
- гестационный герпес;
- депрессия;
- хронические воспалительные заболевания кишечника (болезнь Крона, язвенный колит).
Применение при беременности и лактации
Беременность
Прием комбинации хлормадинон + этинилэстрадиол в период беременности противопоказан. В случае Белара® следует немедленно прекратить его прием. Многочисленные эпидемиологические исследования не выявили ни увеличения риска возникновения дефектов развития у детей, рожденных женщинами, получавшими половые гормоны до беременности, ни наличия тератогенного действия, когда половые гормоны принимались по неосторожности в ранние сроки беременности.
Период грудного вскармливания
Применение препарата Белара®, как и других КОК, может уменьшать количество грудного молока и изменять его состав, поэтому прием препарата противопоказан до прекращения грудного вскармливания. Небольшое количество входящих в состав контрацептива гормонов и/или их метаболитов может проникать в грудное молоко и оказывать влияние на здоровье ребенка.
Побочное действие
При приеме препарата Белара® наиболее часто встречающимися нежелательными реакциями (более 20% случаев) являются «прорывные» кровотечения, кровянистые выделения из влагалища, головная боль и неприятные ощущения в области молочных желез. Частота ациклических кровотечений обычно уменьшается по мере увеличения продолжительности приема препарата Белара®.
Частота возникновения нежелательных реакций указана согласно рекомендациям ВОЗ:
- Очень часто: ≥1/10;
- Часто: ≥1/100, <1/10;
- Нечасто: ≥1/1000, <1/100;
- Редко: ≥1/10000, <1/1000;
- Очень редко: <1/10000.
Могут наблюдаться нежелательные реакции со стороны следующих органов и систем:
Инфекционные и паразитарные заболевания
Нечасто: кандидоз влагалища;
Редко: вульвовагинит.
Доброкачественные, злокачественные и неуточненные новообразования (включая кисты и полипы)
Нечасто: фиброаденома молочной железы.
Нарушения со стороны иммунной системы
Нечасто: гиперчувствительность к компонентам препарата, включая аллергические реакции со стороны кожи.
Нарушения со стороны обмена веществ и питания
Редко: повышение аппетита.
Нарушения психики
Часто: подавленное настроение, нервозность, раздражительность;
Нечасто: снижение либидо.
Нарушения со стороны нервной системы
Часто: головокружение, мигрень (и/или ее усиление).
Нарушения со стороны органа зрения
Часто: расстройства зрения;
Редко: конъюнктивит, непереносимость контактных линз.
Нарушения со стороны органа слуха и лабиринтные нарушения
Редко: внезапная потеря слуха, шум в ушах.
Нарушения со стороны сосудов
Редко: повышение артериального давления, снижение артериального давления, сердечно-сосудистый коллапс, варикозная болезнь вен, тромбоз вен, венозная тромбоэмболия, артериальная тромбоэмболия*.
(* — См. подраздел «Описание отдельных нежелательных реакций»).
Нарушения со стороны желудочно-кишечного тракта
Очень часто: тошнота;
Часто: рвота;
Нечасто: боль в животе, вздутие живота, диарея.
Нарушения со стороны кожи и подкожных тканей
Часто: угревая сыпь;
Нечасто: нарушения пигментации, хлоазма, алопеция, сухость кожи, повышенная потливость;
Редко: крапивница, экзема, эритема, кожный зуд, усиление псориаза, гипертрихоз;
Очень редко: узловатая эритема.
Нарушения со стороны скелетно-мышечной и соединительной ткани
Часто: чувство тяжести;
Нечасто: боль в спине, мышечные расстройства.
Нарушения со стороны половых органов и молочной железы
Очень часто: выделения из влагалища, дисменорея, аменорея;
Часто: боль в нижних отделах живота;
Нечасто: галакторея;
Редко: увеличение молочных желез, меноррагия, предменструальноподобный синдром.
Общие расстройства и нарушения в месте введения
Часто: усталость, отеки, увеличение массы тела.
Лабораторные и инструментальные данные
Нечасто: изменение концентрации липидов в крови, включая гипертриглицеридемию.
В пострегистрационном периоде применения комбинации хлормадинона и этинилэстрадиола сообщалось о следующих нежелательных реакциях: астения и аллергические кожные реакции, не связанные с нарушениями со стороны иммунной системы.
Описание отдельных нежелательных реакций
При применении КОК, в том числе комбинации хлормадинон + этинилэстрадиол, также сообщалось о следующих нежелательных реакциях:
- повышенный риск артериальных и венозных тромбозов и тромбоэмболий, включая инфаркт миокарда, инсульт, ТИА, венозный тромбоз, ТЭЛА наблюдался у женщин, принимавших КОК (см. раздел «Особые указания»);
- по данным некоторых исследований, длительное применение КОК повышает риск развития заболеваний желчевыводящих путей;
- в редких случаях после приема КОК регистрировались случаи возникновения доброкачественных опухолей печени, еще реже регистрировались злокачественные опухоли, которые могут приводить к угрожающему жизни внутрибрюшному кровотечению (см. раздел «Особые указания»);
- обострение хронических воспалительных заболеваний кишечника (болезнь Крона, язвенный колит) (см. раздел «Особые указания»).
Информация о других серьезных нежелательных реакциях, таких как рак матки или рак молочной железы, представлена в разделе «Особые указания».
Взаимодействие
«Прорывные» кровотечения и/или неэффективность контрацепции могут быть следствием взаимодействия других лекарственных средств (индукторов «печеночных» ферментов) с КОК (см. раздел «Взаимодействие с другими лекарственными средствами»).
Если любые из указанных в инструкции нежелательных реакций усугубляются, или Вы заметили любые другие нежелательные реакции, не указанные в инструкции, сообщите об этом лечащему врачу.
Передозировка
Данные о серьезном токсическом действии препарата при передозировке отсутствуют.
Могут наблюдаться следующие симптомы: тошнота, рвота, и, особенно у молодых девушек, незначительные кровянистые выделения из влагалища.
Лечение
Специфического антидота нет; проводят симптоматическую терапию. В редких случаях может быть необходим контроль показателей водно-электролитного баланса и функции печени.
Особые указания
Курение
Курение увеличивает риск серьезных сердечно-сосудистых осложнений, связанных с приемом КОК. Риск повышается с возрастом, при увеличении количества выкуриваемых сигарет и является высоким у женщин старше 35 лет. Курящие женщины старше 35 лет должны использовать другие методы контрацепции.
Применение КОК связано с повышенным риском различных серьезных заболеваний, таких как инфаркт миокарда, тромбоэмболия, инсульт или новообразования печени. Другие факторы риска, такие как артериальная гипертензия, гиперлипидемия, ожирение и сахарный диабет, существенно увеличивают риск осложнений и смертности.
При наличии одного из следующих заболеваний/состояний или факторов риска следует взвесить потенциальный риск и ожидаемую пользу от применения комбинации хлормадинон + этинилэстрадиол, а также обсудить это с женщиной до того, как она начнет прием данного препарата. В случае обострения заболеваний, ухудшения состояния или появления первых симптомов состояний/заболеваний или факторов риска женщине следует немедленно обратиться к врачу для решения вопроса о прекращении приема препарата.
Тромбоэмболия или другие сосудистые заболевания
Результаты эпидемиологических исследований показывают, что существует взаимосвязь между приемом КОК и увеличением риска венозных и артериальных тромбоэмболических заболеваний, например, инфаркта миокарда, кровоизлияния в головной мозг, ТГВ и ТЭЛА. Эти заболевания развиваются редко. Крайне редко у пациенток, принимающих КОК, сообщалось о развитии тромбозов других кровеносных сосудов, например, печеночных, брыжеечных, почечных или вен и артерий сетчатки глаза.
Риск развития ВТЭ и АТЭ
Результаты эпидемиологических исследований указывают на наличие взаимосвязи между применением КОК и повышением частоты развития венозных и артериальных тромбозов и тромбоэмболий (таких как ТГВ и ТЭЛА, инфаркт миокарда, цереброваскулярные нарушения). Данные заболевания отмечаются редко. Риск развития ВТЭ максимален в первый год приема таких препаратов. Повышенный риск присутствует после первоначального применения КОК или возобновления применения после перерыва между приемами препарата в 4 недели и более. Данные крупного проспективного исследования с участием 3 групп пациенток показывают, что этот повышенный риск присутствует преимущественно в течение первых 3 месяцев. Лекарственные препараты, содержащие в качестве прогестагенного компонента левоноргестрел, норгестимат или норэтистерон, имеют самый низкий риск развития ВТЭ. Неизвестно, насколько риск развития ВТЭ при приеме комбинации хлормадинон + этинилэстрадиол превышает риск данного осложнения при приеме препаратов левоноргестрела, норгестимата или норэтистерона.
ВТЭ может оказаться жизнеугрожающей или привести к летальному исходу (в 1–2% случаев).
ВТЭ, проявляющаяся в виде ТГВ или ТЭЛА, может произойти при применении любых КОК.
Симптомы ТГВ: односторонний отек нижней конечности или по ходу вены, боль или дискомфорт только в вертикальном положении или при ходьбе, локальное повышение температуры, покраснение или изменение окраски кожных покровов пораженной нижней конечности.
Симптомы ТЭЛА: затрудненное или учащенное дыхание; внезапный кашель, в том числе с кровохарканием; острая боль в грудной клетке, которая может усиливаться при глубоким вдохе; чувство тревоги; сильное головокружение; учащенное или нерегулярное сердцебиение. Некоторые из этих симптомов (например, одышка и кашель) являются неспецифическими и могут быть истолкованы неверно как признаки других более часто встречающихся и менее тяжелых заболеваний (например, инфекция дыхательных путей).
АТЭ может привести к инсульту, окклюзии сосудов или инфаркту миокарда.
Симптомы инсульта: внезапная слабость или потеря чувствительности в области лица, конечностей, особенно с одной стороны тела, внезапная спутанность сознания, одно‑ или двухсторонняя потеря зрения, нарушение походки, головокружение, потеря равновесия или координации движений, сильная или продолжительная головная боль без видимой причины; проблемы с речью и пониманием, потеря сознания или обморок с судорожным приступом или без него.
Другие признаки окклюзии сосудов: внезапная боль, отечность и незначительная синюшность конечностей, «острый» живот.
Симптомы инфаркта миокарда: боль, дискомфорт, давление, тяжесть, чувство сжатия или распирания в груди или за грудиной, с иррадиацией в спину, челюсть, верхнюю конечность, область эпигастрия; холодный пот, тошнота, рвота или головокружение, сильная слабость, тревога или одышка; учащенное или нерегулярное сердцебиение.
АТЭ может оказаться жизнеугрожающей или привести к летальному исходу.
У женщин с сочетанием нескольких факторов риска или высокой выраженностью одного из них следует рассматривать возможность их взаимоусиления. В подобных случаях степень повышения риска может оказаться более высокой, чем при простом суммировании факторов. В этом случае прием комбинации хлормадинон + этинилэстрадиол противопоказан.
Риск развития венозного и/или артериального тромбоза, или тромбоэмболии или цереброваскулярных нарушений повышается:
- с возрастом;
- у курящих (риск увеличивается в большей степени у женщин старше 35 лет);
- при наличии в семейном анамнезе венозного или артериального тромбоза, или тромбоэмболии у братьев, сестер или у родителей в возрасте менее 50 лет (в случае предполагаемой наследственной предрасположенности перед началом приема КОК следует проконсультироваться со специалистом);
- при ожирении (ИМТ более чем 30 кг/м2);
- при дислипопротеинемии;
- при артериальной гипертензии;
- при мигрени;
- при заболеваниях клапанов сердца;
- при фибрилляции предсердий;
- в случае длительной иммобилизации, серьезного хирургического вмешательства, любой операции на нижних конечностях, в области таза или нейрохирургического оперативного вмешательства, обширной тяжелой травмы. В этих ситуациях следует прекратить прием КОК (в случае планируемой операции, по крайней мере, за четыре недели до нее) и не возобновлять его в течение двух недель после окончания иммобилизации.
Временная иммобилизация (например, авиаперелет длительностью более 4 часов) может также являться фактором риска развития ВТЭ, особенно при наличии других факторов риска.
Вопрос о возможной роли варикозного расширения вен и поверхностного тромбофлебита в развитии ВТЭ остается спорным.
Следует учитывать повышенный риск развития тромбоэмболических осложнений в послеродовом периоде.
Нарушения периферического кровообращения также могут отмечаться при сахарном диабете, системной красной волчанке, гемолитико-уремическом синдроме, хронических воспалительных заболеваниях кишечника (болезнь Крона или язвенный колит) и серповидно-клеточной анемии.
Увеличение частоты и тяжести мигрени на фоне приема комбинации хлормадинон + этинилэстрадиол (что может предшествовать цереброваскулярным нарушениям) является основанием для немедленного прекращения приема этих препаратов.
К биохимическим показателям, указывающим на наследственную или приобретенную предрасположенность к развитию венозного или артериального тромбоза относятся: резистентность к активированному протеину C, гипергомоцистеинемия, дефицит антитромбина III, дефицит протеина C, дефицит протеина S, антифосфолипидные антитела (антитела к кардиолипину, волчаночный антикоагулянт).
При оценке соотношения «польза–риск» следует учитывать, что терапия данных состояний/заболеваний может снизить связанный с ними риск развития тромбоэмболических осложнений.
Женщины, принимающие препарат хлормадинон + этинилэстрадиол, должны быть проинформированы о том, что в случае возникновения возможных симптомов тромбоза им следует немедленно обратиться к врачу, прием препарата следует прекратить.
Опухоли
Наиболее существенным фактором риска развития рака шейки матки (РШМ) является персистирующая папилломавирусная инфекция. Имеются сообщения о некотором повышении риска развития РШМ при длительном приеме КОК. Связь с приемом КОК не доказана. Однако до настоящего времени существуют противоречия относительно степени влияния на эти данные различных факторов, в частности скрининговых обследований шейки матки или особенностей полового поведения женщины (количества сексуальных партнеров или использования барьерных методов контрацепции), а также причинно-следственной взаимосвязи этих факторов.
По данным мета‑анализа результатов 54 эпидемиологических исследований было выявлено небольшое повышение (в 1,24) риска развития рака молочной железы (РМЖ) у женщин, применяющих КОК. Повышенный риск постепенно уменьшается в течение 10 лет после прекращения приема КОК. В связи с тем, что РМЖ отмечается редко у женщин до 40 лет, увеличение количества случаев РМЖ у женщин, принимающих КОК в настоящее время или принимавших его недавно, является незначительным по отношению к общему риску этого заболевания. Его связь с приемом КОК не доказана. Наблюдаемое повышение риска может быть также следствием более ранней диагностики РМЖ у женщин, принимающих КОК (у них диагностируются более ранние клинические формы РМЖ, чем у женщин, не принимавших КОК), биологическим действием КОК или сочетанием обоих этих факторов.
Крайне редко при применении КОК наблюдались случаи развития доброкачественных, и еще более редко — злокачественных опухолей печени. В отдельных случаях эти опухоли приводили к представляющим угрозу для жизни внутрибрюшному кровотечению.
В случае появления сильных болей в области живота, увеличения печени или признаков внутрибрюшного кровотечения, следует учитывать это при проведении дифференциального диагноза.
Другие состояния
У женщин с гипертриглицеридемией или соответствующим семейным анамнезом повышен риск развития панкреатита при приеме КОК.
Несмотря на то, что незначительное повышение артериального давления (АД) было описано у многих женщин, принимающих КОК, клинически значимое повышение отмечалось редко. Тем не менее, если на фоне приема КОК развивается стойкое клинически значимое повышение АД, прием комбинации хлормадинон + этинилэстрадиол необходимо прекратить и начать антигипертензивную терапию. После нормализации АД прием контрацептива может быть продолжен.
У женщин с наличием в анамнезе гестационного герпеса на фоне приема КОК возможен рецидив этого заболевания.
При острых или хронических заболеваниях печени может потребоваться прекращение приема препарата до нормализации показателей функции печени.
Рецидив холестатической желтухи, развившейся впервые во время предшествующей беременности или предыдущего приема половых гормонов, требует прекращения приема КОК.
Прием комбинации хлормадинон + этинилэстрадиол может оказывать влияние на периферическую инсулинорезистентность и толерантность к глюкозе; женщины с сахарным диабетом должны находиться под тщательным медицинским наблюдением во время приема препарата.
В редких случаях возможно появление хлоазмы, особенно у женщин с хлоазмой беременных в анамнезе. Женщины со склонностью к хлоазме во время приема КОК должны избегать длительного пребывания на солнце и воздействия ультрафиолетового облучения.
Сообщалось об обострении эндогенной депрессии, эпилепсии, болезни Крона и язвенного колита на фоне приема КОК.
Подавленное настроение и депрессия являются общеизвестными нежелательными реакциями при применении гормональных контрацептивов. Депрессия может быть серьезной и является широко известным фактором риска суицидального поведения и суицида. Женщинам следует обратиться к своему врачу в случае возникновения перепадов настроения и появления депрессивных симптомов, в том числе вскоре после начала лечения.
У женщин с наследственными формами ангионевротического отека экзогенные эстрогены могут вызывать или усиливать симптомы ангионевротического отека.
Прием препаратов, содержащих эстроген или эстроген + прогестаген, может отрицательно повлиять на некоторые заболевания и состояния, требуется тщательное медицинское наблюдение:
- рассеянный склероз;
- тетания;
- бронхиальная астма;
- хроническая сердечная или почечная недостаточность;
- хорея;
- сахарный диабет;
- заболевания печени;
- дислипопротеинемия;
- артериальная гипертензия;
- эндометриоз;
- порфирия;
- варикозное расширение вен;
- тромбофлебит;
- нарушения свертываемости крови;
- мастопатия;
- аутоиммунные заболевания, включая системную красную волчанку;
- гестационный герпес;
- миома матки.
Медицинские осмотры
Перед началом или возобновлением приема комбинации хлормадинон + этинилэстрадиол необходимо ознакомиться с анамнезом жизни, семейным анамнезом женщины, провести общемедицинское (включая измерение АД, определение ИМТ) и гинекологическое обследование (включая обследование молочных желез и цитологическое исследование эпителия шейки матки), исключить беременность. Объем дополнительных исследований и частота контрольных осмотров определяются индивидуально не реже 1 раза в 6 месяцев. Следует сообщить женщине, что препарат не предохраняет от ВИЧ‑инфекции (СПИД) и других инфекций, передающихся половым путем!
Снижение эффективности
Пропущенный прием таблеток (см. подраздел «Рекомендации в случае пропуска приема препарата»), рвота или кишечные расстройства, включая диарею, длительный сопутствующий прием некоторых лекарственных препаратов (см. раздел «Взаимодействие с другими лекарственными средствами») или, в очень редких случаях, нарушение обмена веществ могут снизить контрацептивную эффективность препарата.
Влияние на контроль менструального цикла
«Прорывные» кровотечения и незначительные кровянистые выделения
Применение КОК может приводить к кровотечениям из влагалища («прорывным» кровотечениям и незначительным кровянистым выделениям), особенно в течение первых циклов приема препарата. Поэтому медицинская оценка нерегулярных циклов должна проводиться только после периода адаптации, составляющего около трех циклов. Если на фоне приема комбинации хлормадинон + этинилэстрадиол постоянно наблюдаются или впервые появляются «прорывные» кровотечения, хотя ранее цикл был регулярным, следует провести обследование с целью исключения беременности или органических заболеваний. После исключения беременности или органического заболевания можно продолжить прием комбинации хлормадинон + этинилэстрадиол или перевести пациентку на прием другого контрацептива.
Межменструальные кровотечения могут быть признаком снижения контрацептивной эффективности (см. подраздел «Рекомендации в случае пропуска приема препарата», «Рекомендации в случае желудочно-кишечных расстройств» и раздел «Взаимодействие с другими лекарственными средствами»).
Отсутствие кровотечения «отмены»
Как правило, через 21 день приема препарата возникает кровотечение «отмены». Иногда, особенно в течение первых месяцев приема препарата, кровотечение «отмены» может отсутствовать. Тем не менее, это не обязательно говорит о снижении контрацептивного эффекта.
Если кровотечение отсутствовало после одного цикла приема, в течение которого женщина не нарушала режим дозирования препарата (не пропускала прием таблеток, не превышала 7‑дневный перерыв в приеме), у пациентки не было рвоты или диареи, то оплодотворение яйцеклетки является маловероятным и прием комбинации хлормадинон + этинилэстрадиол может быть продолжен.
Если до первого отсутствия кровотечения «отмены» прием комбинации хлормадинон + этинилэстрадиол происходил с нарушением инструкции или кровотечение «отмены» отсутствует в течение двух циклов, то следует исключить беременность до продолжения приема препарата.
Не следует принимать лекарственные препараты растительного происхождения, содержащие зверобой продырявленный (Hypericum perforatum), совместно с комбинацией хлормадинон + этинилэстрадиол (см. раздел «Взаимодействие с другими лекарственными средствами»).
Повышение активности АЛТ
Во время клинических исследований лечения гепатита C с применением омбитасвира/паритапревира/ритонавира/дасабувира с рибавирином или без него было выявлено повышение активности АЛТ более, чем в 5 раз выше верхней границы нормы, возникающее чаще у женщин, получающих КОК с ЭЭ (см. разделы «Противопоказания» и «Взаимодействие с другими лекарственными средствами»). До начала приема данной комбинации женщинам, принимающим комбинацию хлормадинон + этинилэстрадиол, следует перейти на альтернативный метод контрацепции (например, на контрацептивные препараты, содержащие только прогестаген или негормональные методы). Прием комбинации хлормадинон + этинилэстрадиол можно возобновить через 2 недели после завершения комбинированной терапии указанными лекарственными препаратами.
Данный препарат содержит лактозу (в виде лактозы моногидрата). Пациентам с такими редкими наследственными заболеваниями, как непереносимость галактозы, лактазная недостаточность или синдром глюкозо-галактозной мальабсорбции, не следует принимать данный препарат.
Влияние на способность к управлению транспортными средствами и механизмами
Данные о негативном влиянии приема КОК на способность к управлению транспортными средствами и механизмами отсутствуют.
Условия хранения
Срок годности
Хранятся в холодильнике
Владелец регистрационного удостоверения
Описание лекарственной формы
Круглые двояковыпуклые таблетки, покрытые пленочной оболочкой светло-розового цвета.
Цвет ядра таблетки: белый или почти белый.
Форма выпуска
