Номидес капсулы 45 мг 10 шт. в Ахтубинске



Самовывоз в Ахтубинске бесплатно
Оплата при получении в аптеке
Действующее вещество Номидес:
Производитель:
Условия отпуска Номидес:
Страна:
Как сделать заказ?
Информация производителя
Способ применения и дозировка
Внутрь, во время еды или независимо от приема пищи. Переносимость препарата можно улучшить, если принимать его во время еды.
В случаях, когда у взрослых, подростков и детей существует проблема с проглатыванием капсул, или при наличии признаков «старения» капсул (например, повышенная хрупкость или другие нарушения физического состояния), необходимо открыть капсулу и высыпать ее содержимое в небольшое количество (максимально 1 чайная ложка) подходящего подслащенного продукта питания (шоколадный сироп с нормальным содержанием сахара или без содержания сахара, мед, светло-коричневый сахар или столовый сахар, растворенный в воде, сладкий десерт, сгущенное молоко с сахаром, яблочное пюре или йогурт) для того, чтобы скрыть горький вкус. Смесь необходимо тщательно перемешать и дать пациенту целиком. Следует проглотить смесь сразу же после приготовления. Подробные рекомендации даны в подразделе «Экстемпоральное приготовление суспензии Номидес®».
Стандартный режим дозирования
Лечение
Прием препарата необходимо начинать не позднее 2 суток с момента развития симптомов заболевания.
Взрослые и подростки в возрасте ≥12 лет
По 75 мг (одна капсула 75 мг или одна капсула 30 мг + одна капсула 45 мг) 2 раза в сутки внутрь в течение 5 дней. Увеличение дозы более 150 мг/сутки не приводит к усилению эффекта.
Дети в возрасте от 1 года до 12 лет
Дети с массой тела >40 кг, которые умеют проглатывать капсулы, также могут получать лечение, принимая по одной капсуле 75 мг (или одна капсула 30 мг + одна капсула 45 мг) 2 раза в сутки в течение 5 дней.
Для детей в возрасте от 1 года возможно экстемпоральное приготовление суспензии с использованием капсул 75 мг, 45 мг и 30 мг (см. подраздел «Экстемпоральное приготовление суспензии Номидес®»).
Применять препарат Номидес® следует 2 раза в сутки в течение 5 дней согласно нижеприведенной таблице:
|
Масса тела |
Рекомендованная доза на один прием |
Количество смеси Номидес® на один прием |
|
≤15 кг |
30 мг |
2 мл |
|
>15–23 кг |
45 мг |
3 мл |
|
>23–40 кг |
60 мг |
4 мл |
|
>40 кг |
75 мг |
5 мл |
Профилактика
Прием препарата необходимо начинать не позднее 2 суток после контакта с заболевшим человеком.
Взрослые и подростки в возрасте ≥12 лет
По 75 мг (одна капсула 75 мг или одна капсула 30 мг + одна капсула 45 мг) 1 раз в сутки внутрь в течение не менее 10 дней после контакта с заболевшим человеком. Во время сезонной эпидемии гриппа — по 75 мг 1 раз в сутки в течение 6 недель. Профилактическое действие продолжается столько, сколько длится прием препарата.
Дети в возрасте от 1 года до 12 лет
Дети с массой тела >40 кг, которые могут проглатывать капсулы, также могут получать профилактическую терапию, принимая по одной капсуле 75 мг (или одна капсула 30 мг + одна капсула 45 мг) 1 раз в сутки в течение 10 дней.
Для детей в возрасте от 1 года возможно экстемпоральное приготовление суспензии с использованием капсул 75 мг, 45 мг и 30 мг (см. подраздел «Экстемпоральное приготовление суспензии Номидес®»).
Применять препарат Номидес® следует 1 раз в сутки в течение 10 дней согласно нижеприведенной таблице:
|
Масса тела |
Рекомендованная доза на один прием |
Количество смеси Номидес® на один прием |
|
≤15 кг |
30 мг |
2 мл |
|
>15–23 кг |
45 мг |
3 мл |
|
>23–40 кг |
60 мг |
4 мл |
|
>40 кг |
75 мг |
5 мл |
Дозирование в особых случаях
Пациенты с поражением почек
Лечение
Пациентам с клиренсом креатинина более 60 мл/мин коррекции дозы не требуется. У пациентов с клиренсом креатинина от 30 до 60 мл/мин дозу препарата Номидес® следует уменьшить до 30 мг два раза в сутки в течение 5 дней (см. подраздел «Экстемпоральное приготовление суспензии Номидес®»).
У пациентов с клиренсом креатинина от 10 до 30 мл/мин дозу препарата Номидес® следует уменьшить до 30 мг один раз в сутки в течение 5 дней. Пациентам, находящимся на постоянном гемодиализе, препарат Номидес® в первоначальной дозе 30 мг можно принять до начала диализа, если симптомы гриппа появились в течение 48 ч между сеансами диализа. Для поддержания плазменной концентрации на терапевтическом уровне препарат Номидес® следует принимать по 30 мг после каждого сеанса диализа. Пациентам, находящимся на перитонеальном диализе, препарат Номидес® следует принимать в первоначальной дозе 30 мг до начала проведения диализа, затем по 30 мг каждые 5 дней. Фармакокинетика осельтамивира у пациентов с терминальной стадией почечной недостаточности (с клиренсом креатинина ≤10 мл/мин), не находящихся на диализе, не изучалась. В связи с этим рекомендации по дозированию у данной группы пациентов отсутствуют.
Профилактика
Пациентам с клиренсом креатинина более 60 мл/мин коррекции дозы не требуется. У пациентов с клиренсом креатинина от 30 до 60 мл/мин дозу препарата Номидес® следует уменьшить до 30 мг один раз в сутки (см. подраздел «Экстемпоральное приготовление суспензии Номидес®»).
У пациентов с клиренсом креатинина от 10 до 30 мл/мин рекомендуется уменьшить дозу препарата Номидес® до 30 мг через день. Пациентам, находящимся на постоянном гемодиализе, препарат Номидес® в первоначальной дозе 30 мг можно принять до начала диализа («1‑й сеанс»). Для поддержания плазменной концентрации на терапевтическом уровне препарат Номидес® следует принимать по 30 мг после каждого последующего нечетного сеанса диализа. Пациентам, находящимся на перитонеальном диализе, препарат Номидес® следует принимать в первоначальной дозе 30 мг до начала проведения диализа, затем по 30 мг каждые 7 дней. Фармакокинетика осельтамивира у пациентов с терминальной стадией почечной недостаточности (с клиренсом креатинина ≤10 мл/мин), не находящихся на диализе, не изучалась. В связи с этим рекомендации по дозированию у данной группы пациентов отсутствуют.
Пациенты с поражением печени
Коррекции дозы при лечении и профилактике гриппа у пациентов с нарушением функции печени легкой и средней степени тяжести не требуется. Безопасность и фармакокинетика осельтамивира у пациентов с тяжелыми нарушениями функции печени не изучалась.
Пациенты пожилого и старческого возраста
Коррекции дозы для профилактики или лечения гриппа не требуется.
Пациенты с ослабленным иммунитетом (после трансплантации)
Лечение
Рекомендованная продолжительность терапии осельтамивиром у пациентов с ослабленным иммунитетом составляет 10 дней. Коррекции дозы не требуется (см. разделы «Побочное действие» и «Фармакологические свойства»). Прием препарата необходимо начинать не позднее 2 суток с момента развития симптомов заболевания.
Сезонная профилактика
Для сезонной профилактики гриппа у пациентов с ослабленным иммунитетом в возрасте ≥1 года — в течение 12 недель, коррекции дозы не требуется.
Дети
Препарат Номидес® не следует назначать детям до 1 года.
Экстемпоральное приготовление суспензии Номидес®
В случаях, когда у взрослых, подростков и детей существует проблема с проглатыванием капсул, или при наличии признаков «старения» капсул, необходимо открыть капсулу и высыпать ее содержимое в небольшое количество (максимально 1 чайная ложка) подходящего подслащенного продукта питания (см. выше) для того, чтобы скрыть горький вкус. Смесь необходимо тщательно перемешать и дать пациенту целиком. Следует проглотить смесь сразу же после приготовления.
Если пациентам требуется доза 75 мг, то необходимо следовать следующим инструкциям:
1. Держа одну капсулу 75 мг препарата Номидес® над маленькой емкостью, аккуратно раскрыть капсулу и высыпать порошок в емкость.
2. Добавить небольшое количество (не более 1 чайной ложки) подходящего подслащенного продукта питания (чтобы скрыть горький вкус) и хорошо перемешать.
3. Тщательно перемешать смесь и выпить ее сразу же после приготовления. Если в емкости осталось небольшое количество смеси, то следует ополоснуть емкость небольшим количеством воды и выпить оставшуюся смесь.
Если пациентам требуются дозы 30–60 мг, то для правильного дозирования необходимо следовать следующим инструкциям:
1. Держа одну капсулу 75 мг препарата Номидес® над маленькой емкостью, аккуратно раскрыть капсулу и высыпать порошок в емкость.
2. Добавить в порошок 5 мл воды с помощью шприца с метками, показывающими количество набранной жидкости. Тщательно перемешать в течение 2 минут.
3. Набрать в шприц необходимое количество смеси из емкости согласно таблицам, приведенным выше.
Нет необходимости в заборе нерастворенного белого порошка, поскольку он является неактивным наполнителем. Нажав на поршень шприца, ввести все его содержимое во вторую емкость. Оставшуюся неиспользованную смесь необходимо выбросить.
4. Во вторую емкость добавить небольшое количество (не более 1 чайной ложки) подходящего подслащенного продукта питания, чтобы скрыть горький вкус, и хорошо перемешать.
5. Тщательно перемешать смесь и выпить ее сразу же после приготовления. Если в емкости осталось небольшое количество смеси, то следует ополоснуть емкость небольшим количеством воды и выпить оставшуюся смесь.
Повторяйте данную процедуру перед каждым приемом препарата.
Капсулы 30 мг и 45 мг
Для правильного дозирования необходимо следовать следующим инструкциям:
1. Определить необходимое количество капсул Номидес®, требующееся для приготовления смеси:
|
Масса тела* |
Количество капсул Номидес® для обеспечения рекомендованной дозы с целью лечения в течение 5 дней |
Количество капсул Номидес® для обеспечения рекомендованной дозы с целью профилактики |
|
≤15 кг |
1 капсула 30 мг 2 раза/сут |
1 капсула 30 мг 1 раз/сут |
|
>15–23 кг |
1 капсула 45 мг 2 раза/сут |
1 капсула 45 мг 1 раз/сут |
|
>23–40 кг |
2 капсулы 30 мг 2 раза/сут |
2 капсулы 30 мг 1 раз/сут |
* Дети с массой тела >40 кг или в возрасте от 8 до 12 лет и взрослые могут получать Номидес®, используя для приготовления смеси одну капсулу 45 мг + одну капсулу 30 мг 2 раза в сутки для лечения или 1 раз в сутки для профилактики.
2. Убедитесь, что используется правильная доза препарата (в соответствии с вышеприведенной таблицей). Держа одну или несколько капсул Номидес® над маленькой емкостью, аккуратно раскрыть одну или несколько капсул и высыпать порошок в емкость.
3. Добавить небольшое количество (не более 1 чайной ложки) подходящего подслащенного продукта питания, чтобы скрыть горький вкус, и хорошо перемешать.
4. Тщательно перемешать смесь и выпить ее сразу же после приготовления. Если в емкости осталось небольшое количество смеси, то следует ополоснуть емкость небольшим количеством воды и выпить оставшуюся смесь.
Повторяйте данную процедуру перед каждым приемом препарата.
Описание
Состав
Действующее вещество:
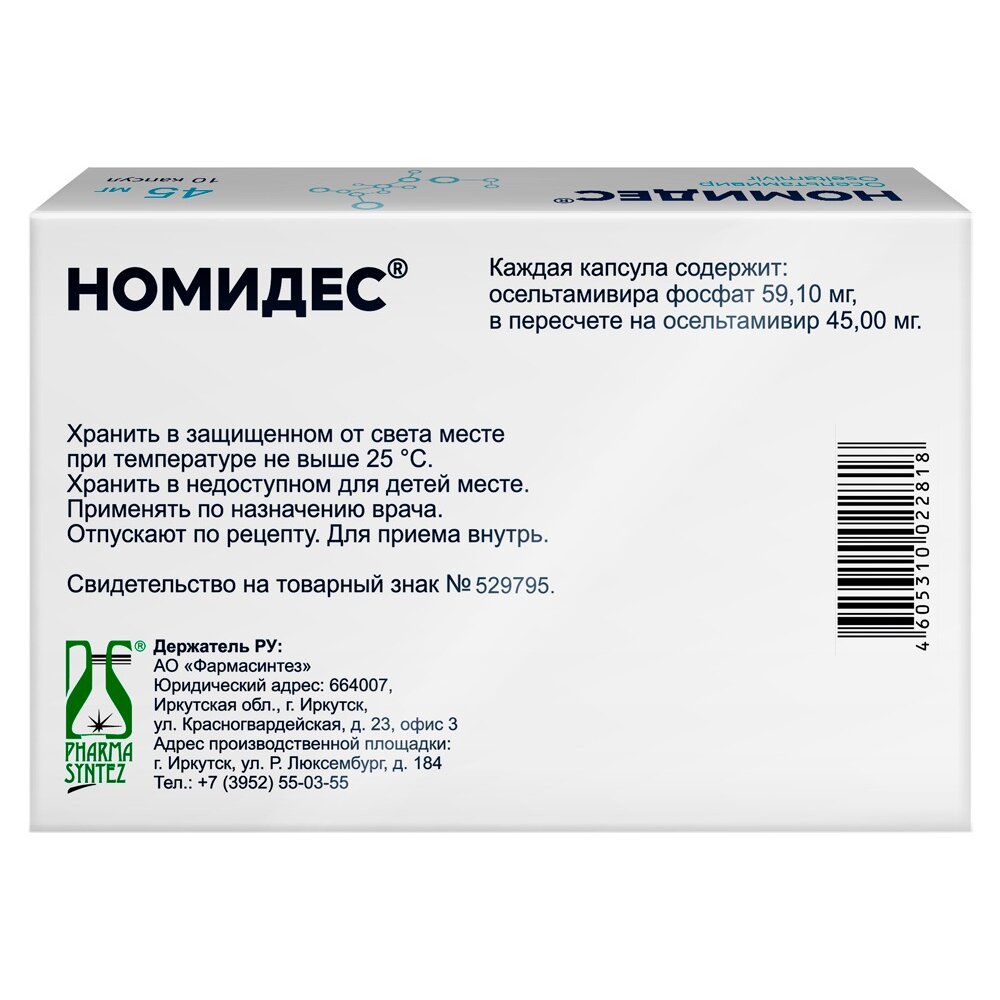
Осельтамивира фосфат: 39,40 мг 59,10 мг 98,50 мг
в пересчете на осельтамивир: 30,00 мг 45,00 мг 75,00 мг
Вспомогательные вещества:
Кремния диоксид коллоидный (аэросил) — 6,00 мг/ 9,00 мг/ 15,00 мг; коповидон — 3,60 мг/ 5,40 мг/ 9,00 мг; крахмал прежелатинизированный — 65,60 мг/ 98,40 мг/ 164,00 мг; кроскармеллоза натрия — 1,840 мг/ 2,760 мг/ 4,60 мг; натрия стеарилфумарат — 0,920 мг/ 1,380 мг/ 2,30 мг; тальк — 2,640 мг/ 3,960 мг/ 6,60 мг.
Состав твердых желатиновых капсул:
Для дозировки 30 мг:
Корпус капсулы: титана диоксид — 2,0000%, желатин — до 100%;
Крышечка капсулы: титана диоксид — 2,0000%, желатин — до 100%.
Для дозировки 45 мг:
Корпус капсулы: краситель бриллиантовый голубой — 0,1500%, титана диоксид — 1,8817%, желатин — до 100%;
Крышечка капсулы: краситель бриллиантовый голубой — 0,1500%, титана диоксид — 1,8817%, желатин — до 100%.
Для дозировки 75 мг:
Корпус капсулы: титана диоксид — 2,0000%, желатин — до 100%;
Крышечка капсулы: краситель пунцовый (Понсо 4R) — 0,2401%, титана диоксид — 1,5004%; краситель солнечный закат желтый E110 — 1,2753%, желатин — до 100%.
Фармакотерапевтическая группа
Показания
– Лечение гриппа у взрослых и детей в возрасте старше 1 года.
– Профилактика гриппа у взрослых и подростков в возрасте старше 12 лет, находящихся в группах повышенного риска инфицирования вирусом (в воинских частях и больших производственных коллективах, у ослабленных пациентов).
– Профилактика гриппа у детей старше 1 года.
Противопоказания
– Гиперчувствительность к осельтамивиру или любому другому вспомогательному веществу.
– Терминальная стадия почечной недостаточности (клиренс креатинина ≤10 мл/мин).
– Тяжелая печеночная недостаточность.
– Детский возраст до 1 года.
С осторожностью
– Беременность, период грудного вскармливания.
– Применение в комбинации с препаратами, имеющими узкую широту терапевтического действия (например, хлорпропамид, метотрексат, бутадион).
Применение при беременности и лактации
Беременность
Неблагоприятный исход беременности и аномалии развития плода, а также риск серьезных врожденных пороков развития, в том числе врожденных пороков сердца, связаны с заболеванием гриппом.
Большое количество данных о воздействии осельтамивира у беременных женщин в ходе пострегистрационного применения и наблюдательных исследований (более 1000 пациентов на первом триместре беременности) не указывают ни на пороки развития, ни на фето/неонатальную токсичность осельтамивира.
Однако в одном наблюдательном исследовании результаты оценки риска развития тяжелых врожденных пороков сердца, диагностированных в течение 12 месяцев после рождения, не были однозначными, хотя общий риск пороков развития и не был увеличен. В данном исследовании частота развития тяжелых врожденных пороков сердца после применения осельтамивира в течение первого триместра беременности составляла 1,76% (7 младенцев из 397 беременностей) по сравнению с 1,01% при беременности в общей популяции без применения осельтамивира (отношение рисков 1,75, 95% доверительный интервал 0,51 до 5,98).
Клиническое значение данного результата до конца не ясно, так как исследование имело ограниченную мощность.
Кроме того, исследование было недостаточно объемным, чтобы провести достоверную оценку отдельных категорий тяжелых пороков развития; при этом данные у женщин, принимавших и не принимавших осельтамивир, не могли быть полностью сопоставимы, независимо от того, болели ли они гриппом.
Исследования на животных не указывают на репродуктивную токсичность осельтамивира (см. раздел «Фармакологические свойства», подраздел «Доклинические данные»).
Применение осельтамивира при беременности возможно в случае необходимости и после оценки имеющейся информации о безопасности и пользе (информацию о пользе применения препарата у беременных женщин см. в подразделе «Фармакодинамика», пункт «Лечение гриппа у беременных женщин»), а также патогенности циркулирующего штамма вируса гриппа.
Грудное вскармливание
Во время доклинических исследований осельтамивир и активный метаболит проникали в молоко лактирующих крыс. Данные по экскреции осельтамивира с грудным молоком у человека и применению осельтамивира кормящими женщинами ограничены. Ограниченные данные показывают, что осельтамивир и его активный метаболит в небольших количествах проникают в грудное молоко, создавая субтерапевтические концентрации в крови грудного ребенка. При назначении осельтамивира кормящим женщинам следует также учитывать сопутствующее заболевание и патогенность циркулирующего штамма вируса гриппа. При беременности и в период грудного вскармливания осельтамивир применяют только в случае, если ожидаемая явная польза для кормящей матери превышает риск для ребенка.
Фертильность
На основании доклинических данных не ожидается, что осельтамивир влияет на фертильность мужчин или женщин (см. раздел «Фармакологические свойства», подраздел «Доклинические данные»).
Побочное действие
Обзор профиля безопасности
Общий профиль безопасности осельтамивира основан на данных 6049 взрослых пациентов/ подростков и 1473 детей с гриппом, получавших осельтамивир или плацебо, а также на данных 3990 взрослых пациентов/ подростков и 253 детей, получающих осельтамивир или плацебо/ не получавших терапии в клинических исследованиях по профилактике гриппа.
Кроме того, 199 взрослых пациентов с ослабленным иммунитетом получили осельтамивир для лечения гриппа, и 475 пациентов с ослабленным иммунитетом (в том числе 18 детей, 10 из которых получали осельтамивир и 8 — плацебо) получили осельтамивир или плацебо для профилактики гриппа.
У взрослых пациентов/подростков наиболее частыми нежелательными реакциями (HP) в ходе клинических исследований лечения гриппа были тошнота и рвота, а в ходе исследований по профилактике — тошнота.
Большинство указанных HP были зарегистрированы однократно в первый или второй день терапии и спонтанно разрешались в течение последующих 1–2 дней.
У детей наиболее часто встречающейся HP была рвота.
У большинства пациентов данные HP не приводили к отмене терапии осельтамивиром.
Серьезные HP, перечисленные ниже, редко отмечались с момента выхода препарата на рынок: анафилактические и анафилактоидные реакции, нарушения со стороны печени (фульминантный гепатит, нарушение функции печени и желтуха), ангионевротический отек, синдром Стивенса-Джонсона и токсический эпидермальный некролиз, желудочно-кишечное кровотечение и нарушения со стороны нервной системы и психики (см. раздел «Особые указания»).
Список нежелательных реакций представлен в табличном формате ниже.
Для описания частоты нежелательных реакций используется следующая классификация: очень частые (≥1/10), частые (≥1/100 и <1/10), нечастые (≥1/1000 и <1/100), редкие (≥1/10000 и <1/1000) и очень редкие (<1/10000). Соответствующая категория присваивается нежелательным реакциям на основании объединенного анализа клинических исследований.
Лечение и профилактика гриппа у взрослых и подростков
В таблице 1 представлены HP, возникавшие наиболее часто при приеме рекомендованной дозы осельтамивира в исследованиях по профилактике и лечению гриппа у взрослых и подростков (75 мг 2 раза в сутки в течение 5 дней для лечения и 75 мг 1 раз в сутки до 6 недель для профилактики).
В исследованиях по профилактике гриппа профиль безопасности у пациентов, получавших рекомендованную дозу осельтамивира (75 мг 1 раз в сутки до 6 недель), качественно не отличался от такового в исследованиях по лечению гриппа, несмотря на более длительный прием препарата.
Таблица 1. Нежелательные реакции, выявленные в ходе клинических исследований по профилактике и лечению гриппа осельтамивиром у взрослых пациентов и подростков или в ходе постмаркетингового наблюдения.
|
Класс систем органов |
Нежелательные реакции, распределенные согласно частоте выявления |
|||
|
Очень часто |
Часто |
Нечасто |
Редко |
|
|
Инфекционные и паразитарные заболевания |
|
Бронхит, Herpes simplex, назофарингит, инфекции верхних дыхательных путей, синусит |
|
|
|
Нарушения со стороны крови и лимфатической системы |
|
|
|
Тромбоцитопения |
|
Нарушения со стороны иммунной системы |
|
|
Реакции гиперчувствительности |
Анафилактические реакции, анафилактоидные реакции |
|
Нарушения психики |
|
|
|
Беспокойство, анормальное поведение, тревожность, спутанность сознания, бред, делирий, галлюцинации, ночные кошмары, причинение себе телесного повреждения |
|
Нарушения со стороны нервной системы |
Головная боль |
Бессонница |
Изменение сознания, судороги |
|
|
Нарушения со стороны органа зрения |
|
|
|
Нарушение зрения |
|
Нарушения со стороны сердца |
|
|
Аритмия |
|
|
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения |
|
Кашель, боль в горле, ринорея |
|
|
|
Нарушения со стороны желудочно-кишечного тракта |
Тошнота |
Рвота, боль в животе (включая боль в верхней части живота), диспепсия |
|
Желудочно-кишечные кровотечения, геморрагический колит |
|
Нарушения со стороны печени и желчевыводящих путей |
|
|
Повышение активности «печеночных» ферментов |
Фульминантный гепатит, печеночная недостаточность, гепатит |
|
Нарушения со стороны кожи и подкожных тканей |
|
|
Экзема, дерматит, сыпь, крапивница |
Ангионевротический отек, мультиформная эритема, синдром Стивенса-Джонсона, токсический эпидермальный некролиз |
|
Общие расстройства и нарушения в месте введения |
|
Боль, головокружение (включая вертиго), утомляемость, лихорадка, боль в конечностях |
|
|
Лечение и профилактика гриппа у детей
В клинических исследованиях осельтамивира при лечении гриппа принимали участие 1473 ребенка (включая в целом здоровых детей в возрасте от 1 до 12 лет и детей с астмой в возрасте от 6 до 12 лет). Из них 851 ребенок получал терапию осельтамивиром в лекарственной форме «суспензия». Всего 158 детей получали рекомендованную дозу осельтамивира 1 раз в сутки в исследованиях постконтактной профилактики в домашних условиях (n = 99), в 6‑недельных исследованиях сезонной профилактики (n = 49) и 12‑недельных исследованиях сезонной профилактики у пациентов с ослабленным иммунитетом (n = 10).
В таблице 2 представлены HP, наиболее часто сообщаемые в ходе клинических исследований у детей.
Таблица 2. Нежелательные реакции, выявленные в ходе клинических исследований по профилактике и лечению гриппа осельтамивиром у детей (доза от 30 мг до 75 мг в зависимости от возраста/веса).
|
Класс систем органов |
Нежелательные реакции, распределенные согласно частоте выявления |
|||
|
Очень часто |
Часто |
Нечасто |
Редко |
|
|
Инфекционные и паразитарные заболевания |
|
Средний отит |
|
|
|
Нарушения со стороны нервной системы |
|
Головная боль |
|
|
|
Нарушения со стороны органа зрения |
|
Конъюнктивит (включая покраснение глаз, выделения и боль) |
|
|
|
Нарушения со стороны органа слуха и лабиринтные нарушения |
|
Боль в ухе |
Нарушения со стороны барабанной перепонки |
|
|
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения |
Кашель, заложенность носа |
Ринорея |
|
|
|
Нарушения со стороны желудочно-кишечного тракта |
Рвота |
Боль в животе (включая боль в верхней части живота), диспепсия, тошнота |
|
|
|
Нарушения со стороны кожи и подкожных тканей |
|
|
Дерматит (включая аллергический и атопический дерматит) |
|
Описание отдельных нежелательных реакций
Нарушения со стороны нервной системы и психики
Гриппозная инфекция может ассоциироваться с различными неврологическими симптомами и изменениями поведения, включая такие симптомы, как галлюцинации, делирий, и анормальное поведение. В некоторых случаях они могут привести к смертельному исходу.
Данные явления могут возникать как на фоне развития энцефалопатии или энцефалита, так и отдельно, без явного тяжелого заболевания.
В постмаркетинговых сообщениях у пациентов, которые получали осельтамивир для лечения гриппа, отмечались судороги и делирий (включая такие симптомы, как нарушение сознания, спутанность сознания, анормальное поведение, бред, галлюцинации, беспокойство, тревожность, ночные кошмары). Эти случаи редко сопровождались опасными для жизни активностями или летальным исходом. Данные явления были зарегистрированы в основном среди детей и подростков и часто имели внезапное начало и быстрое разрешение.
Роль осельтамивира в развитии данных явлений неизвестна. Указанные психоневрологические нарушения также были зарегистрированы у пациентов с гриппом, не получавших осельтамивир.
Нарушения со стороны печени и желчевыводящих путей
Нарушения со стороны печени и желчевыводящих путей, включая гепатит и повышение активности «печеночных» ферментов, отмечались у пациентов с гриппоподобным заболеванием. Указанные явления также включали фульминантный гепатит/печеночную недостаточность с фатальным исходом.
Прочие особые популяции пациентов
Дети (до 1 года)
В двух исследованиях фармакокинетики, фармакодинамики и профиля безопасности осельтамивира, в которых принимали участие 135 детей в возрасте до 1 года с гриппом, профиль безопасности препарата был сопоставим в различных возрастных группах. Наиболее часто сообщаемыми нежелательными явлениями при этом были рвота, диарея и опрелость (см. раздел «Фармакологические свойства», подраздел «Фармакокинетика»). Данные о детях в постконцептуальном возрасте до 36 недель недостаточны.
Данные по безопасности применения осельтамивира при лечении у детей в возрасте до 1 года получены из проспективных и ретроспективных наблюдательных исследований (включали более 2400 детей данного возраста), исследований эпидемиологических баз данных и постмаркетингового наблюдения. Профиль безопасности у детей до 1 года сопоставим с известным профилем безопасности у детей в возрасте 1 года и старше.
Пожилые пациенты и пациенты с хронической сердечной и/или дыхательной недостаточностью
Популяция, включенная в исследования по лечению гриппа, состояла из в целом здоровых взрослых/подростков и пациентов группы риска (риск развития осложнений гриппа, например, популяция пожилых пациентов и пациентов с хронической сердечной или дыхательной недостаточностью). В целом профиль безопасности препарата у пациентов группы риска был сопоставим с таковым у в целом здоровых взрослых/подростков.
Пациенты с ослабленным иммунитетом
Лечение гриппа у пациентов с ослабленным иммунитетом оценивалось в двух клинических исследованиях: пациенты получали стандартную дозу или повышенную дозу (двойную или тройную) осельтамивира (см. раздел «Фармакологические свойства»). Профиль безопасности препарата, наблюдаемый в данных исследованиях, был сопоставим с таковым в предыдущих клинических исследованиях, в которых осельтамивир применялся для лечения пациентов с нормальным иммунитетом среди всех возрастных групп (здоровые пациенты или пациенты из группы риска, например, с дыхательной и/или сердечной недостаточностью). Наиболее частым нежелательным явлением у детей с ослабленным иммунитетом была рвота (28%).
В ходе 12‑недельного исследования по профилактике гриппа у 475 пациентов с ослабленным иммунитетом (включая 18 детей в возрасте от 1 до 12 лет и старше) профиль безопасности в группе осельтамивира (238 пациентов) был сопоставим с раннее наблюдаемым профилем осельтамивира в клинических исследованиях по профилактике.
Дети с бронхиальной астмой в анамнезе
В целом профиль нежелательных реакций у детей с бронхиальной астмой в анамнезе был сопоставим с таковым в целом у здоровых детей.
Передозировка
В большинстве случаев передозировка в ходе клинических исследований и при пострегистрационном применении осельтамивира не сопровождалась какими‑либо нежелательными явлениями. В остальных случаях симптомы передозировки соответствовали нежелательным явлениям, представленным в разделе «Побочное действие».
Особые указания
Осельтамивир эффективен только в отношении заболевания, вызванного вирусом гриппа. Данные об эффективности осельтамивира при терапии заболеваний, вызванных иными агентами, отсутствуют (см. раздел «Фармакологические свойства», подраздел «Фармакодинамика»).
Осельтамивир не является заменой вакцинации.
Использование осельтамивира не должно влиять на оценку пациентов при проведении ежегодной вакцинации против гриппа.
Препарат следует использовать только для лечения и профилактики гриппа и только в случае, если достоверные эпидемиологические данные указывают на то, что вирус гриппа циркулирует в общей популяции.
Чувствительность циркулирующих штаммов вируса гриппа к осельтамивиру может сильно варьировать (см. раздел «Фармакологические свойства», подраздел «Фармакодинамика», пункт «Резистентность»).
Таким образом, при назначении препарата необходимо учитывать самую последнюю доступную информацию о чувствительности циркулирующего вируса к осельтамивиру.
Тяжелое сопутствующее заболевание
Данные о безопасности и эффективности применения осельтамивира у пациентов с достаточно тяжелым сопутствующим заболеванием или нестабильным состоянием, предполагающим госпитализацию, отсутствуют.
Пациенты с ослабленным иммунитетом
Эффективность осельтамивира при лечении или профилактике гриппа у пациентов с ослабленным иммунитетом четко не установлена (см. раздел «Фармакологические свойства», подраздел «Фармакодинамика»). Однако у взрослых пациентов с ослабленным иммунитетом лечение гриппа следует проводить на протяжении 10 дней, так как клинические исследования при более коротком курсе терапии не проводились.
Сердечная/ дыхательная недостаточность
Эффективность осельтамивира при лечении или профилактике гриппа у пациентов с хронической сердечной и/или дыхательной недостаточностью не установлена. В данной популяции пациентов частота возникновения осложнений была сопоставима в группе лечения и группе плацебо.
Дети
Данные для определения дозы у недоношенных детей (постконцептуальный возраст <36 недель) отсутствуют.
Почечная недостаточность тяжелой степени тяжести
У взрослых пациентов и подростков (13–17 лет) с тяжелой степенью почечной недостаточности при лечении и профилактике гриппа рекомендуется коррекция дозы. Клинические данные для коррекции дозы у младенцев и детей (в возрасте от 1 года и старше) с почечной недостаточностью отсутствуют (см. разделы «Способ применения и дозы» и «Фармакологические свойства», подраздел «Фармакокинетика»).
Психоневрологические нарушения
У пациентов (в основном у детей и подростков), принимавших осельтамивир, были зарегистрированы психоневрологические нарушения. Подобные психоневрологические нарушения так же отмечены у пациентов с гриппом, не получавших осельтамивир. Следует тщательно мониторировать пациентов на предмет изменений в поведении, риск и польза продолжения терапии должны быть оценены для каждого пациента индивидуально (см. раздел «Побочное действие»).
Инструкции по применению, обращению и уничтожению
Попадание лекарственных препаратов в окружающую среду должно быть сведено к минимуму. Не следует утилизировать препарат с помощью сточных вод или вместе с бытовыми отходами. По возможности необходимо использовать специальные системы для утилизации лекарственных препаратов.
Вспомогательные вещества, наличие которых надо учитывать в составе лекарственного препарата
В составе препарата Номидес® в качестве вспомогательных веществ используются краситель солнечный закат желтый E110 и краситель пунцовый (Понсо 4R), которые могут вызывать аллергические реакции.
Влияние на способность управлять транспортными средствами и механизмами
Препарат не влияет, либо оказывает незначительное влияние на способность управлять транспортными средствами и механизмами.
Условия хранения
Срок годности
Хранятся в холодильнике
Владелец регистрационного удостоверения
Описание лекарственной формы
Для дозировки 30 мг: твердые желатиновые капсулы № «3», корпус белого цвета, крышечка белого цвета.
Для дозировки 45 мг: твердые желатиновые капсулы № «2», корпус голубого цвета, крышечка голубого цвета.
Для дозировки 75 мг: твердые желатиновые капсулы № «1», корпус белого цвета, крышечка оранжевого цвета.
Содержимое капсул — белый или белый с желтоватым оттенком порошок.
Форма выпуска
