Ко-Диован таблетки 160+12,5 мг 28 шт. в Козьмодемьянске

Форма выпуска:
Дозировка:
Фасовка:
Действующее вещество Диован:
Производитель:
Условия отпуска Диован:
Страна:
Как сделать заказ?
Информация производителя
Способ применения и дозировка
Препарат следует принимать ежедневно внутрь 1 раз в сутки, запивая небольшим количеством воды, независимо от приема пищи, предпочтительно в одно и то же время. В зависимости от клинической ситуации, рекомендуемая суточная доза — 1 таблетка, содержащая валсартан + гидрохлоротиазид в фиксированной комбинации дозировкой 80 + 12,5 мг, 160 + 12,5 мг.
Не рекомендовано применение препарата для начальной терапии у пациентов с уменьшением ОЦК.
Максимальная суточная доза составляет 320 + 25 мг.
Максимальный антигипертензивный эффект отмечается как правило в течение 2–4 недель.
Нарушение функции почек
У пациентов с нарушением функции почек легкой и средней степени (СКФ ≥30 мл/мин/1,73 м2) коррекции дозы препарата не требуется. Препарат не следует применять у пациентов с анурией или нарушением функции почек тяжелой степени (СКФ <30 мл/мин/1,73 м2) вследствие наличия в составе гидрохлоротиазида. Применение тиазидных диуретиков в монотерапии у пациентов с нарушением функции почек тяжелой степени (СКФ <30 мл/мин/1,73 м2) неэффективно, однако у пациентов данной категории возможно одновременное применение с «петлевыми» диуретиками с соблюдением особой осторожности.
Нарушение функции печени
Не требуется коррекции дозы у пациентов с нарушением функции печени легкой и средней степени (класс А и В по классификации Чайлд-Пью). Следует соблюдать осторожность у пациентов с нарушением функции печени средней степени (класс В по классификации Чайлд-Пью), а также пациентов с обструктивными заболеваниями желчевыводящих путей.
Применение у детей и подростков в возрасте до 18 лет
Поскольку безопасность и эффективность препарата Ко‑Диован® у детей и подростков младше 18 лет не установлены, применение у пациентов данной категории противопоказано.
Описание
Состав
1 таблетка, покрытая пленочной оболочкой, содержит:
Действующие вещества:
Валсартан + гидрохлоротиазид в количественном соотношении 80 мг + 12,5 мг / 160 мг + 12,5 мг;
Вспомогательные вещества:
Целлюлоза микрокристаллическая, кросповидон, магния стеарат, кремния диоксид коллоидный;
Пленочная оболочка:
Суспензия красителя белого (гипромеллоза, титана диоксид (E171)), суспензия красителя красного (гипромеллоза, краситель железа оксид красный (E172)), суспензия красителя желтого (гипромеллоза, краситель железа оксид желтый (E172) содержится в дозировке 80 мг + 12,5 мг), гипромеллоза, макрогол 8000, тальк.
Фармакотерапевтическая группа
Показания
Артериальная гипертензия у взрослых (пациентам, которым показана комбинированная терапия).
Противопоказания
- Повышенная чувствительность к валсартану, гидрохлоротиазиду, другим производным сульфонамида или любому другому компоненту препарата;
- беременность, планирование беременности, период грудного вскармливания;
- нарушение функции печени тяжелой степени (класс C по классификации Чайлд‑Пью);
- анурия, нарушение функции почек тяжелой степени (СКФ <30 мл/мин/1,73 м2);
- детский возраст до 18 лет (безопасность и эффективность не установлены);
- одновременное применение с алискиреном и препаратами, содержащими алискирен, у пациентов с сахарным диабетом и/или умеренными или тяжелыми нарушениями функции почек (СКФ менее 60 мл/мин/1,73 м2 площади поверхности тела);
- рефрактерная гипокалиемия, гипонатриемия, гиперкальциемия.
С осторожностью
- Одновременное применение с калийсодержащими пищевыми добавками, калийсберегающими диуретиками, калийсодержащими заменителями соли, а также другими препаратами, которые могут увеличивать содержание калия;
- односторонний или двусторонний стеноз почечной артерии или стеноз артерии единственной почки;
- состояния, сопровождающиеся нарушениями водно-электролитного баланса: нефропатии, сопровождающейся потерей солей, и преренальным (кардиогенным) нарушением функции почек; гипокалиемия, гипомагниемия, гипонатриемия, гиперкальциемия;
- выраженный дефицит натрия и/или снижение объема циркулирующей крови (ОЦК) (например, у пациентов, получающих высокие дозы диуретиков);
- нарушение функции печени средней степени (класс B по классификации Чайлд-Пью);
- хроническая сердечная недостаточность (ХСН) III–IV функционального класса по классификации NYHA, митральный или аортальный стеноз, гипертрофическая обструктивная кардиомиопатия;
- системная красная волчанка;
- первичный гиперальдостеронизм;
- сахарный диабет, гиперурикемия;
- гиперхолестеринемия и гипертриглицеридемия;
- обструктивные заболевания желчевыводящих путей и холестаз;
- аллергические реакции на пенициллин в анамнезе;
- состояние после трансплантации почки;
- одновременное применение лекарственных препаратов, которые могут вызывать полиморфную желудочковую тахикардию типа «пируэт»;
- подагра;
- немеланомный рак кожи в анамнезе;
- одновременное применение лекарственных препаратов, способных вызывать гипокалиемию, и препаратов лития.
Применение при беременности и лактации
Беременность
Резюме рисков
Как для любого другого препарата, оказывающего прямое действие на РААС, противопоказано применение препарата Ко‑Диован® при беременности. Учитывая механизм действия АРА II, нельзя исключить риск для плода. Известно, что применение ингибиторов АПФ (класс специфичных лекарственных средств, действующих на РААС) во II и III триместре беременности приводит к поражению и гибели плода. По данным ретроспективного анализа применение ингибиторов АПФ в I триместре беременности ассоциируется с потенциальным риском возникновения пороков развития плода. Гидрохлоротиазид проникает через плаценту. При непреднамеренном приеме валсартана при беременности описаны случаи самопроизвольного прерывания беременности, маловодия и нарушения функции почек у новорожденных.
Внутриутробное воздействие тиазидных диуретиков, включая гидрохлоротиазид, на плод ассоциируется с развитием желтухи или тромбоцитопении у плода или новорожденного, а также может ассоциироваться с другими нежелательными реакциями, отмеченными у взрослых. В случае если беременность диагностирована в период лечения препаратом Ко‑Диован®, препарат следует отменить как можно раньше.
Клинические аспекты
Материнский и/или эмбриофетальный риск, ассоциированный с заболеванием
Артериальная гипертензия при беременности увеличивает риск развития преэклампсии, гестационного сахарного диабета, преждевременных родов, а также осложнений в родах (например, необходимость кесарева сечения, развитие послеродового кровотечения). При артериальной гипертензии увеличивается риск задержки внутриутробного развития плода и внутриутробной гибели плода.
Риск со стороны плода/новорожденного
Маловодие у беременных, принимающих препараты, влияющие на РААС во II и III триместре, может приводить к ухудшению функции почек плода, что в результате приводит к анурии и почечной недостаточности, гипоплазии легких плода, деформации скелета плода, включая гипоплазию костей черепа, артериальной гипотензии и гибели плода.
При непреднамеренном приеме препаратов АРА во время беременности следует рассмотреть вопрос о необходимости соответствующего мониторинга состояния плода.
Новорожденных, матери которых получали терапию АРА, следует тщательно наблюдать относительно развития артериальной гипотензии.
Валсартан
При изучении эмбриофетального развития у мышей, кроликов и крыс наблюдалась фетотоксичность, которая ассоциировалась с материнской токсичностью у крыс при применении валсартана в суточной дозе 600 мг/кг в сутки, что приблизительно в 18 раз превышает максимальную рекомендованную суточную дозу для человека из расчета мг/кг массы тела (расчет предполагает суточную дозу 320 мг внутрь для пациента с массой тела 60 кг), и кроликов при применении валсартана в суточной дозе 10 мг/кг, что приблизительно в 0,6 раз превышает максимальную рекомендованную суточную дозу для человека из расчета мг/кг массы тела (расчет предполагает суточную дозу 320 мг внутрь для пациента с массой тела 60 кг). Не отмечено явлений материнской токсичности или фетотоксичности при применении у мышей в суточных дозах до 600 мг/кг, что приблизительно в 9 раз превышает максимальную рекомендованную суточную дозу для человека из расчета мг/кг массы тела (расчет предполагает суточную дозу 320 мг внутрь для пациента с массой тела 60 кг).
Гидрохлоротиазид
Не отмечено тератогенности и влияния гидрохлоротиазида на фертильность и оплодотворение в исследовании у 3 видов животных, которые получали гидрохлоротиазид внутрь. У крыс не отмечено дозозависимой фетотоксичности при применении внутрь в дозах 0, 100, 300 и 1000 мг/кг. Отставание набора массы тела у молочных крысят было обусловлено высокими дозами и диуретическим эффектом гидрохлоротиазида и соответствующим влиянием на продукцию молока.
Грудное вскармливание
Неизвестно, проникает ли валсартан в грудное молоко. В доклинических исследованиях показано, что валсартан выделяется с молоком лактирующих крыс.
Гидрохлоротиазид выделяется с грудным молоком. Применение препарата во время грудного вскармливания противопоказано.
Пациентки и пациенты с сохраненным репродуктивным потенциалом
Как и любой другой препарат, оказывающий прямое действие на РААС, препарат Ко‑Диован® не следует применять у женщин, планирующих беременность. При выборе любого препарата, воздействующего на РААС, врачу следует проинформировать пациентку с сохраненным репродуктивным потенциалом о возможном риске применения препарата во время беременности.
Фертильность
Данных о влиянии валсартана или гидрохлоротиазида на фертильность у человека нет. В доклинических исследованиях не отмечено влияния валсартана или гидрохлоротиазида на фертильность у крыс.
Побочное действие
Ниже в соответствии с системно-органным классом указаны нежелательные лекарственные реакции (НЛР) по данным клинических исследований и лабораторные данные, которые встречались чаще при применении валсартана и гидрохлоротиазида в сравнении с плацебо, а также отдельные сообщения, полученные в пострегистрационном периоде.
Нежелательные реакции (HP), зарегистрированные ранее при применении каждого компонента в монотерапии, могут возникать при применении препарата Ко‑Диован®, даже в том случае, если они не были зарегистрированы в клинических исследованиях данного препарата. Для оценки частоты использованы следующие критерии (согласно классификации Всемирной организации здравоохранения (ВОЗ)): очень часто (≥1/10); часто (≥1/100, <1/10); нечасто (≥1/1000, <1/100); редко (≥1/10000, <1/1000); очень редко (<1/10000); частота неизвестна (недостаточно данных для оценки частоты развития). В пределах каждого органного класса НР перечислены в порядке уменьшения важности.
|
Системно-органный класс |
Нежелательная реакция |
Ко‑Диован® |
Валсартан |
Гидрохлоротиазид |
|
Доброкачественные, злокачественные и неуточненные новообразования (включая кисты и полипы) |
Немеланомный рак кожи (базальноклеточная карцинома кожи и плоскоклеточный рак кожи, см. раздел «Особые указания») |
— |
— |
частота неизвестна |
|
Нарушения со стороны крови и лимфатической системы |
тромбоцитопения, иногда в сочетании с пурпурой |
— |
частота неизвестна |
редко |
|
лейкопения |
— |
— |
очень редко |
|
|
агранулоцитоз |
— |
— |
очень редко |
|
|
угнетение костномозгового кроветворения |
— |
— |
очень редко |
|
|
гемолитическая анемия |
— |
— |
очень редко |
|
|
апластическая анемия |
— |
— |
частота неизвестна |
|
|
снижение гемоглобина и гематокрита |
— |
частота неизвестна |
— |
|
|
нейтропения |
частота неизвестна |
— |
— |
|
|
Нарушения со стороны иммунной системы |
некротизирующий васкулит |
— |
— |
очень редко |
|
гиперчувствительность, включая сывороточную болезнь |
— |
частота неизвестна |
— |
|
|
Реакции гиперчувствительности — респираторный дистресс, включая некардиогенный отек легких и пневмонит |
— |
— |
очень редко |
|
|
Нарушения со стороны обмена веществ и питания |
повышение содержания калия в крови |
— |
частота неизвестна |
— |
|
гипокалиемия |
частота неизвестна |
— |
— |
|
|
повышение концентрации липидов в плазме крови |
— |
— |
очень часто (в основном на фоне высоких доз гидрохлоротиазида) |
|
|
гипонатриемия |
частота неизвестна |
— |
— |
|
|
гипомагниемия |
— |
— |
часто |
|
|
гиперурикемия |
— |
— |
часто |
|
|
ухудшение аппетита |
— |
— |
часто |
|
|
гиперкальциемия |
— |
— |
редко |
|
|
гипергликемия |
— |
— |
редко |
|
|
глюкозурия и ухудшение метаболического состояния при сахарном диабете |
— |
— |
редко |
|
|
гипохлоремический алкалоз |
— |
— |
очень редко |
|
|
дегидратация |
нечасто |
— |
— |
|
|
Нарушения психики |
нарушения сна |
— |
— |
редко |
|
депрессия |
— |
— |
редко |
|
|
Нарушения со стороны нервной системы |
головная боль |
— |
— |
редко |
|
головокружение |
очень редко |
— |
редко |
|
|
парестезия |
нечасто |
— |
редко |
|
|
синкопе |
частота неизвестна |
— |
|
|
|
Нарушения со стороны органа зрения |
нарушение зрения |
— |
— |
редко (особенно в первые несколько недель лечения) |
|
нечеткость зрения |
нечасто |
— |
— |
|
|
острый приступ закрытоугольной глаукомы |
— |
— |
частота неизвестна |
|
|
хориоидальный выпот |
— |
— |
частота неизвестна |
|
|
Нарушения со стороны органа слуха и лабиринтные нарушения |
шум в ушах |
нечасто |
— |
— |
|
вертиго |
— |
нечасто |
— |
|
|
Нарушения со стороны сердца |
аритмия |
— |
— |
редко |
|
Нарушения со стороны сосудов |
ортостатическая гипотензия (может усиливаться при употреблении алкоголя, седативных или обезболивающих средств) |
— |
— |
часто |
|
васкулит |
— |
частота неизвестна |
— |
|
|
артериальная гипотензия |
нечасто |
— |
— |
|
|
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения |
некардиогенный отек легких |
частота неизвестна |
— |
— |
|
кашель |
нечасто |
— |
— |
|
|
Нарушения со стороны пищеварительной системы |
боль в животе |
— |
нечасто |
— |
|
слабо выраженная тошнота |
— |
— |
часто |
|
|
рвота |
— |
— |
часто |
|
|
запор |
— |
— |
редко |
|
|
диарея |
очень редко |
— |
редко |
|
|
панкреатит |
— |
— |
очень редко |
|
|
дискомфорт в животе |
— |
— |
редко |
|
|
Нарушения со стороны печени и желчевыводящих путей |
повышение активности «печеночных» ферментов |
— |
частота неизвестна |
— |
|
внутрипеченочный холестаз или желтуха |
— |
— |
редко |
|
|
Нарушения со стороны кожи и подкожных тканей |
кожный зуд |
— |
частота неизвестна |
— |
|
кожная сыпь |
|
частота неизвестна |
|
|
|
реакция фотосенсибилизации |
— |
— |
редко |
|
|
ангионевротический отек |
— |
частота неизвестна |
— |
|
|
крапивница и другие виды кожной сыпи |
— |
— |
часто |
|
|
буллезный дерматит |
— |
частота неизвестна |
— |
|
|
некротизирующий васкулит и токсический эпидермальный некролиз |
— |
— |
очень редко |
|
|
волчаночноподобные реакции |
— |
— |
очень редко |
|
|
обострение кожных проявлений системной красной волчанки |
— |
— |
очень редко |
|
|
мультиформная эритема |
— |
— |
частота неизвестна |
|
|
Нарушения со стороны скелетно-мышечной и соединительной ткани |
миалгия |
нечасто |
— |
— |
|
мышечный спазм |
— |
— |
частота неизвестна |
|
|
артралгия |
очень редко |
— |
— |
|
|
Нарушения со стороны почек и мочевыводящих путей |
почечная недостаточность |
— |
частота неизвестна |
частота неизвестна (острая почечная недостаточность) |
|
нарушение функции почек |
частота неизвестна |
— |
частота неизвестна |
|
|
Нарушения со стороны половых органов и молочной железы |
эректильная дисфункция |
— |
— |
часто |
|
Общие расстройства и нарушения в месте введения |
повышенная утомляемость |
нечасто |
— |
— |
|
астения |
— |
— |
частота неизвестна |
|
|
гипертермия |
— |
— |
частота неизвестна |
|
|
Лабораторные и инструментальные данные |
повышение концентрации мочевой кислоты в крови |
частота неизвестна |
— |
— |
|
повышение концентрации билирубина в крови |
частота неизвестна |
— |
— |
|
|
повышение концентрации креатинина в крови |
частота неизвестна |
— |
— |
|
|
повышение концентрации мочевины в крови |
частота неизвестна |
— |
— |
Следующие явления наблюдались у пациентов с артериальной гипертензией во время клинических исследований вне зависимости от связи с препаратом: боль в животе, боль в верхней части живота, тревога, артрит, астения, боль в спине, бронхит, острый бронхит, боль в груди, постуральное головокружение, диспепсия, одышка, сухость слизистой оболочки полости рта, носовое кровотечение, эректильная дисфункция, гастроэнтерит, головная боль, повышенное потоотделение, гипестезия, грипп, бессонница, растяжение связок, мышечный спазм, мышечный гипертонус, заложенность носа, назофарингит, тошнота, боль в шее, отек, периферический отек, средний отит, боль в конечности, ощущение сердцебиения, боль в гортани и глотке, поллакиурия, пирексия, синусит, заложенность придаточных пазух, сомноленция, тахикардия, инфекции верхних дыхательных путей, инфекции мочевыводящих путей, вертиго, вирусные инфекции, нарушение зрения.
HP, зарегистрированные ранее при применении каждого компонента в монотерапии, могут возникать при применении препарата Ко‑Диован®, даже в том случае, если они не были зарегистрированы в клинических исследованиях данного препарата и при применении в пострегистрационном периоде.
Следующие явления наблюдались во время клинических исследований валсартана у пациентов с артериальной гипертензией независимо от их причинной связи с исследуемым препаратом: артралгия, астения, боль в спине, диарея, головокружение, головная боль, бессонница, снижение либидо, тошнота, периферический отек, фарингит, ринит, синусит, инфекция верхних дыхательных путей, вирусные инфекции.
Передозировка
Симптомы
При передозировке валсартаном можно ожидать развития выраженной артериальной гипотензии вплоть до угнетения сознания, сосудистого коллапса и/или шока. При передозировке гидрохлоротиазидом возможно появление следующих симптомов: тошнота, сонливость, гиповолемия, а также нарушение водно-электролитного баланса, ассоциированное с нарушением ритма сердца и мышечными спазмами.
Лечение
Лечение зависит от времени, прошедшего с момента приема препарата, типа и степени тяжести симптомов, стабилизация гемодинамики имеет первостепенное значение. В случае, если препарат был принят недавно, следует рассмотреть возможность индукции рвоты. При выраженной артериальной гипотензии пациента следует уложить с приподнятым ножным концом, провести внутривенную инфузию изотонического раствора натрия хлорида. Валсартан не выводится с помощью гемодиализа по причине его значительного связывания с белками плазмы крови. В то же время для выведения из организма гидрохлоротиазида гемодиализ эффективен.
Особые указания
Комбинированная терапия препаратом возможна при недостаточном контроле АД на фоне применения отдельных монокомпонентов.
При необходимости многокомпонентной медикаментозной терапии в качестве начальной терапии для достижения целевых значений АД применение препарата возможно после тщательной оценки отношения польза/риск.
Изменение содержания электролитов в сыворотке крови
Валсартан
Одновременное применение с калийсодержащими пищевыми добавками, калийсберегающими диуретиками, калийсодержащими заменителями соли, а также другими препаратами, которые могут увеличивать содержание калия (например, гепарин) не рекомендуется. По мере необходимости следует контролировать содержание калия в сыворотке крови.
Гидрохлоротиазид
Терапия тиазидными диуретиками может приводить к развитию гипокалиемии или усугублять уже существующую гипокалиемию. Тиазидные диуретики следует применять с осторожностью при состояниях, сопровождающихся потерей калия (например, нефропатии, кардиогенное нарушение функции почек).
В случае симптоматической гипокалиемии (например, мышечная слабость, парестезии, изменения на электрокардиограмме, ЭКГ) применение препарата следует прекратить. До начала терапии тиазидными диуретиками следует скорректировать существующую гипокалиемию и гипомагниемию. Следует периодически определять содержание калия и магния в сыворотке крови. Тиазидные диуретики могут увеличивать экскрецию магния с мочой, что может привести к гипомагниемии. Экскреция кальция уменьшается на фоне приема тиазидных диуретиков, что, как следствие, может привести к гиперкальциемии.
При применении препарата Ко‑Диован® следует учитывать способность тиазидных диуретиков вызывать гипонатриемию и гипохлоремический алкалоз, а также усугублять имеющуюся гипонатриемию. Гипонатриемия в этих случаях редко сопровождается неврологической симптоматикой (тошнота, прогрессирующая дезориентация, апатия). Необходим регулярный контроль содержания натрия в сыворотке крови.
С целью своевременного выявления возможных нарушений водно-электролитного баланса во время терапии тиазидными диуретиками у всех пациентов необходимо контролировать содержание электролитов (особенно калия).
Дефицит в организме натрия и/или ОЦК
У пациентов с выраженным дефицитом натрия и/или со снижением ОЦК (например, у пациентов, получающих высокие дозы диуретиков), в редких случаях в начале лечения препаратом Ко‑Диован® может возникать симптоматическая артериальная гипотензия. Перед началом лечения следует провести коррекцию содержания натрия и/или нарушения ОЦК, в противном случае лечение необходимо начинать под строгим врачебным контролем. В случае развития артериальной гипотензии пациента следует уложить и, при необходимости, провести внутривенную инфузию 0,9% раствора натрия хлорида. После стабилизации АД лечение препаратом Ко‑Диован® может быть продолжено.
Стеноз почечной артерии
У пациентов с односторонним или двусторонним стенозом почечной артерии или стенозом артерии единственной почки прием препарата Ко‑Диован® может сопровождаться повышением концентрации мочевины и креатинина в сыворотке крови, в связи с чем следует с осторожностью применять препарат у данных пациентов.
Нет данных по применению препарата у пациентов с трансплантированной почкой.
Стеноз аортального и митрального клапанов, гипертрофическая обструктивная кардиомиопатия
У пациентов с аортальным или митральным стенозом, а также с гипертрофической обструктивной кардиомиопатией следует применять препарат с особой осторожностью.
Нарушение функции почек
Препарат не следует применять у пациентов с тяжелыми нарушениями функции почек (СКФ <30 мл/мин/1,73 м2) вследствие наличия в составе препарата гидрохлоротиазида. У пациентов с хроническим заболеванием почек тиазидные диуретики могут вызывать азотемию. Применение тиазидных диуретиков в монотерапии у пациентов с нарушениями функции почек тяжелой степени (скорость клубочковой фильтрации СКФ <30 мл/мин/1,73 м2) неэффективно, однако одновременное применение с «петлевыми» диуретиками с должной осторожностью у пациентов данной категории возможно. Для пациентов с нарушениями функции почек легкой и средней степени (СКФ ≥30 ‑ ≤90 мл/мин/1,73 м2) коррекция начальной дозы не требуется.
Одновременное применение с алискиреном и препаратами, содержащими алискирен, у пациентов с сахарным диабетом и/или умеренным или тяжелыми нарушениями функции почек (СКФ <60 мл/мин/1,73 м2) противопоказано.
Пациентам с нарушениями функции почек следует контролировать уровни калия, креатинина и мочевой кислоты в сыворотке крови.
Нарушение функции печени
У пациентов с нарушением функции печени слабой и средней степени (класс А и В по классификации Чайлд-Пью) коррекции дозы не требуется. Следует соблюдать осторожность при применении препарата у пациентов с обструктивными заболеваниями желчевыводящих путей. У пациентов с печеночной недостаточностью или прогрессирующими заболеваниями печени тиазидные диуретики следует применять с осторожностью, поскольку даже небольшое изменение водно-электролитного баланса может вызвать печеночную кому. Применение препарата у пациентов с нарушением функции печени тяжелой степени противопоказано.
Ангионевротический отек
Возникновение реакций гиперчувствительности на фоне применения гидрохлоротиазида наиболее вероятно у пациентов с аллергическими реакциями и бронхиальной астмой в анамнезе.
При применении валсартана отмечено развитие ангионевротического отека, в том числе отека гортани и голосовых связок, приводящее к обструкции дыхательных путей и/или отека лица, губ, глотки и/или языка; у некоторых из таких пациентов отмечено развитие ангионевротического отека в анамнезе при применении других лекарственных препаратов, в том числе ингибиторов АПФ. При развитии ангионевротического отека препарат следует немедленно отменить без повторного возобновления терапии.
Системная красная волчанка
При применении тиазидных диуретиков, включая гидрохлоротиазид, сообщалось об усугублении или активации системной красной волчанки.
Другие метаболические нарушения
Тиазидные диуретики, включая гидрохлоротиазид, могут вызывать изменение толерантности к глюкозе, а также повышение концентрации холестерина и триглицеридов в сыворотке крови.
Снижение клиренса мочевой кислоты может привести к гиперурикемии и развитию подагры у предрасположенных пациентов.
Тиазидные диуретики снижают экскрецию кальция почками и могут вызывать незначительное повышение содержания кальция в сыворотке крови при отсутствии сопутствующих нарушений метаболизма кальция. Гидрохлоротиазид следует с осторожностью применять у пациентов с гиперкальциемией. Выраженная гиперкальциемия на фоне терапии тиазидным диуретиком (≥12 мг/дл), не отвечающая на отмену препарата, может свидетельствовать о наличии сопутствующего нарушения метаболизма кальция.
У нескольких пациентов с гиперкальциемией и гипофосфатемией на фоне длительного применения тиазидных диуретиков определяли патологические изменения паращитовидных желез. В случае выявления гиперкальциемии требуется провести дополнительные обследования с целью уточнения диагноза.
Первичный гиперальдостеронизм
Не рекомендуется назначение терапии препаратом Ко‑Диован® у пациентов с первичным гиперальдостеронизмом ввиду нарушения функционального состояния РААС.
Фоточувствительность
Сообщается о случаях развития реакций фоточувствительности при приеме тиазидных диуретиков. В случае появления фоточувствительности на фоне приема гидрохлоротиазида следует прекратить лечение. Если продолжение приема диуретика необходимо, то следует защищать кожные покровы от воздействия солнечных лучей или искусственных ультрафиолетовых лучей.
Хориоидальный выпот / острая миопия / острая закрытоугольная глаукома
Тиазидные и тиазидоподобные диуретики могут вызывать идиосинкразическую реакцию, приводящую к развитию хориоидального выпота с нарушением полей зрения, острой транзиторной миопии и острой закрытоугольной глаукомы. Симптомы включают острое начало снижения остроты зрения или боль в глазу и обычно возникают в течение нескольких часов или недель после начала приема препарата. При отсутствии лечения острый приступ закрытоугольной глаукомы может привести к стойкой потере зрения. В первую очередь необходимо как можно быстрее отменить прием препарата. Если внутриглазное давление остается неконтролируемым, может потребоваться неотложное медикаментозное лечение или хирургическое вмешательство. Факторами риска развития острого приступа закрытоугольной глаукомы являются аллергические реакции на тиазидоподобные диуретики и пенициллины в анамнезе.
Недостаточность кровообращения III–IV функционального класса по классификации NYHA, в том числе после перенесенного инфаркта миокарда
Применение ингибиторов АПФ или АРА II в случаях, когда состояние функции почек зависит от активности РААС (например, у пациентов с сердечной недостаточностью), ассоциировалось с развитием олигурии и/или прогрессирующей азотемии, в редких случаях приводило к острой почечной недостаточности и/или летальному исходу. При оценке состояния пациента с острой сердечно-сосудистой недостаточностью или перенесенным инфарктом миокарда во всех случаях необходимо определять состояние функции почек.
Немеланомный рак кожи
В двух эпидемиологических исследованиях с использованием данных Датского национального онкологического регистра отмечено увеличение риска развития немеланомного рака кожи (базальноклеточной карциномы и плоскоклеточного рака кожи) с увеличением кумулятивной дозы воздействия гидрохлоротиазида. Риск развития немеланомного рака кожи увеличивается при долгосрочном применении гидрохлоротиазида, потенциальным механизмом развития которого может являться его фотосенсибилизирующее действие.
Пациента, принимающего гидрохлоротиазид, следует информировать о риске развития немеланомного рака кожи и рекомендовать регулярно осматривать кожные покровы на предмет появления новых образований, а также своевременно сообщать о появлении подозрительных кожных образований. С целью уменьшения риска развития рака кожи пациенту следует рекомендовать превентивные меры, например, ограничение воздействия солнечного света и адекватную защиту от солнца. Подозрительные кожные образования следует незамедлительно обследовать, возможно, включая гистологическое исследование биоптата. Следует пересмотреть возможность применения гидрохлоротиазида у пациентов с немеланомным раком кожи в анамнезе (см. раздел «Побочное действие»).
На основании имеющихся данных эпидемиологических исследований отмечена связь между совокупной дозой гидрохлоротиазида и немеланомным раком кожи. В одно из исследований были включены 71533 случаев базальноклеточной карциномы и 8629 случаев плоскоклеточного рака кожи, сопоставленных соответственно с 1430833 и 172462 контрольными субъектами в популяции. Высокая совокупная доза гидрохлоротиазида (≥50000 мг) ассоциировалась со скорректированным отношением рисков (ОР) для базальноклеточной карциномы 1,29 (95% ДИ: 1,23–1,35) и 3,98 (95% ДИ: 3,68–4,31) — для плоскоклеточного рака кожи. Отмечено четкое отношение доза-эффект как для базальноклеточной карциномы кожи, так и для плоскоклеточного рака кожи. В другом исследовании с использованием выборки методом «случай-контроль» показана возможная ассоциация рака губы (плоскоклеточный рак кожи) и воздействия гидрохлоротиазида: 633 случаев рака губы, сопоставленных с 63067 контрольными субъектами в популяции. Отмечено четкое отношение доза-эффект со скорректированным ОР 2,1 (95% ДИ: 1,7–2,6), который возрастает до 3,9 (95% ДИ: 3,0–4,9) для высоких доз (~25000 мг), и 7,7 (95% ДИ: 5,7–10,5) для наивысшей совокупной дозы (~100000 мг). К примеру, совокупная доза 100000 мг соответствует >10 годам ежедневного применения в установленной суточной дозе 25 мг (см. раздел «Побочное действие» и «Особые указания»).
Прочее
Следует с осторожностью применять препарат у пациентов с ранее установленными случаями повышенной чувствительности к другим антагонистам рецепторов ангиотензина II.
Влияние на способность управлять транспортными средствами, механизмами
Пациентам, принимающим препарат Ко‑Диован®, следует соблюдать осторожность при управлении транспортными средствами и механизмами.
Условия хранения
Срок годности
Хранятся в холодильнике
Владелец регистрационного удостоверения
Описание лекарственной формы
Таблетки, покрытые пленочной оболочкой, 80 мг + 12,5 мг: овальной формы, двояковыпуклые таблетки, покрытые пленочной оболочкой светло-розового цвета, без риски. На одной стороне нанесена гравировка «HGH», на другой — «CG».
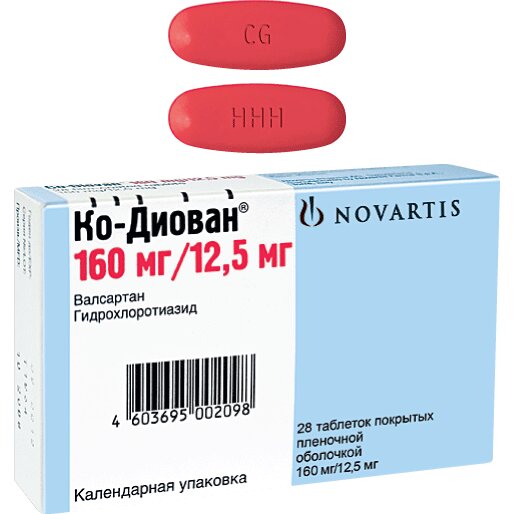
Таблетки, покрытые пленочной оболочкой, 160 мг + 12,5 мг: овальной формы, двояковыпуклые таблетки, покрытые пленочной оболочкой от темно-красного до коричневато-красного цвета, без риски. На одной стороне нанесена гравировка «ННН», на другой — «CG».
Форма выпуска
